概要
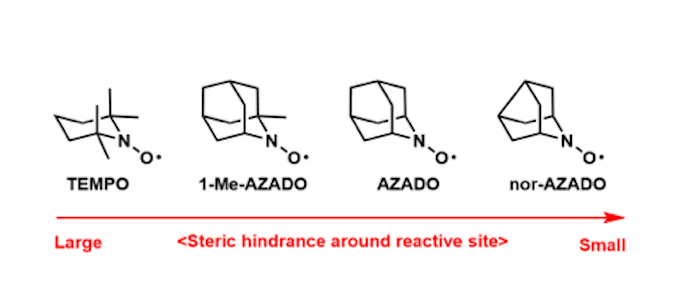
烷基取代的羟胺在空气下容易被氧化,如果胺的α位碳原子上有氢的话会消去生成nitrone(硝酮)、而若是α位碳正好是桥头碳(小于八个碳的桥环化合物中)消去氢也无法再桥头形成双键(见Bredt’ rule),无法生成硝酮时,则氧化产物以氮氧自由基的形式存在。这类自由基可以作为温和条件下醇氧化为羰基的氧化催化剂使用。 长期以来TEMPO作为氧化催化剂被应用,不过由日本东北大学的岩淵(Iwabuchi)教授开发了活性中心周围的立体位阻比TEMPO小的AZADO系列高活性氧化催化剂,并能更广泛用于多种底物。(TEMPO氧化反应参见之前的内容) 另外近年来通过与铜或铁催化剂的组合实现了高化学选择性的氧气氧化反应也陆续被报道。
基本文献
<AZADO & Me-AZADO>
- Shibuya, M.; Tomizawa, M.; Suzuki, I.; Iwabuchi, Y. J. Am. Chem. Soc. 2006, 128, 8412. DOI: 10.1021/ja0620336
<ABNO>
- Shibuya, M.; Tomizawa, M.; Sasano, Y.; Iwabuchi, Y. J. Org. Chem. 2009, 74, 4619. DOI: 10.1021/jo900486w
<keto-ABNO>
- Sonobe, T.; Oisaki, K.; Kanai, M. Chem. Sci. 2012, 3, 3249. DOI: 10.1039/C2SC20699D
<nor-AZADO>
- Hayashi, M.; Sasano, Y.; Nagawsawa, S.; Shibuya, M.; Iwabuchi, Y. Chem. Pharm. Bull. 2011, 59, 1570. doi:10.1248/cpb.59.1570
<review>
- 澁谷正俊, 岩淵好治 有機合成化学協会誌 2013, 71, 515. doi:10.5059/yukigoseikyokaishi.71.515
- Iwabuchi, Y. Chem. Pharm. Bull. 2013, 61, 1197. doi:10.1248/cpb.c13-00456
反应机理
催化剂循环的机理与TEMPO氧化类似。
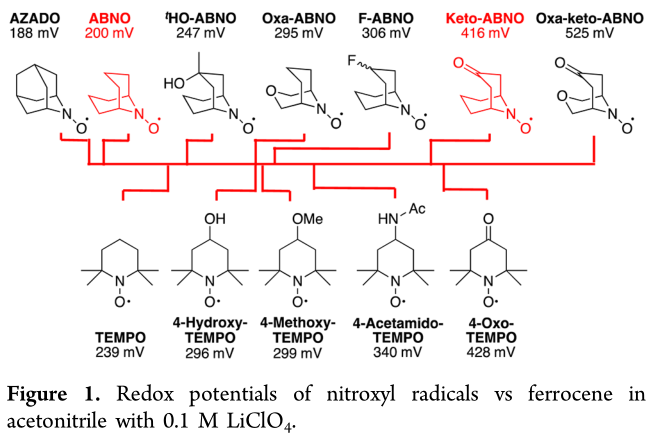
各类氮氧自由基由于结构和取代基的不同,使得氧化还原电位变大。这样能够通过结构调整来调节氧化活性。(参考:Tetrahedron Lett. 2012, 53, 2070.)
反应实例
包含不同立体化学的醇的氧化[1]
次氯酸作为共氧化剂时可将醇一步氧化到羧酸。[2]
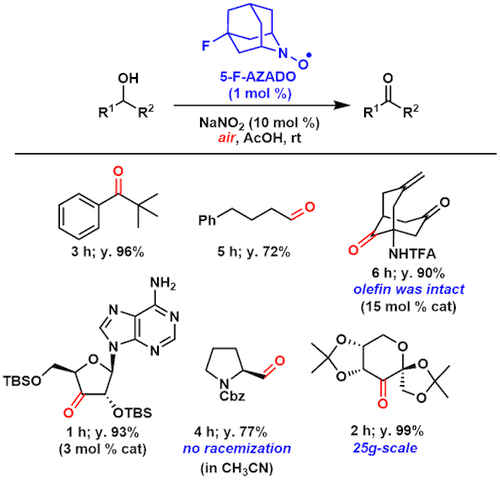
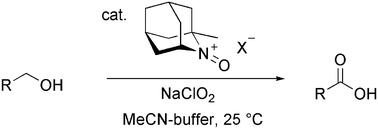 NOx共存下可由氧气做氧化剂。[3]
NOx共存下可由氧气做氧化剂。[3]
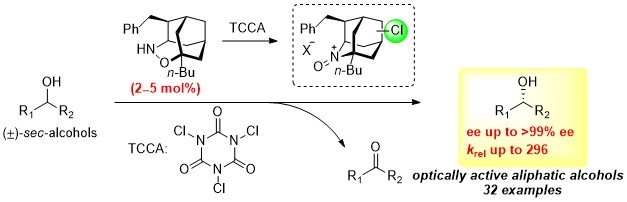
催化剂如果具有手性的话,可以实现动力学光学拆分氧化。[4]
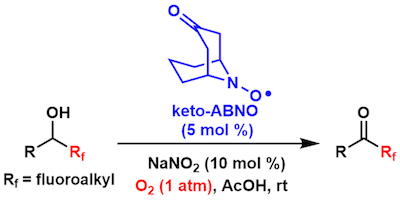
含氟的醇的温和氧化[5]
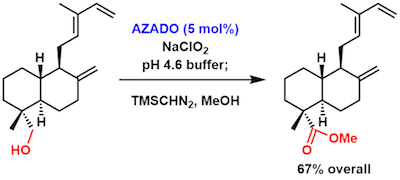
Taiwaniadducts的全合成[6]
Sphingofungin E的合成[7]:经由氰醇的氧化可以氧化通常条件下难氧化的位置。
(-)-acetylaranotin的合成[8]
参考文献
- Shibuya, M.; Tomizawa, M.; Suzuki, I.; Iwabuchi, Y. J. Am. Chem. Soc. 2006, 128, 8412. DOI: 10.1021/ja0620336
- Shibuya, M.; Sato, T.; Tomizawa, M.; Iwabuchi, Y. Chem. Commun. 2009, 1739. DOI: 10.1039/B822944A
- (a) Shibuya, M.; Osada, Y.; Sasano, Y.; Tomizawa, M.; Iwabuchi, Y. J. Am. Chem. Soc. 2011, 133, 6497. doi:10.1021/ja110940c (b) Liu, R.; Liang, X.; Dong, C.; Hu, X. J. Am. Chem. Soc. 2004, 126, 4112. DOI: 10.1021/ja031765k (c) Lauber, M. B.; Stahl, S. S. ACS Catal. 2013, 3, 2612. DOI: 10.1021/cs400746m
- Murakami, K.; Sasano, Y.; Tomizawa, M.; Shibuya, M.; Kwon, E.; Iwabuchi, Y. J. Am. Chem. Soc.2014, 136, 17591. DOI: 10.1021/ja509766f
- Kadoh, Y.; Tashiro, M.; Oisaki, K.; Kanai, M. Adv. Synth. Catal. 2015, DOI: 10.1002/adsc.201500131
- Deng, J.; Zhou, S.; Zhang, W.l Li, J.; Li, R.; Li, A. J. Am. Chem. Soc. 2014, 136, 8185. DOI: 10.1021/ja503972p
- Ikeuchi, K.; Hayashi, M.; Yamamoto, T.; Inai, M.; Asakawa, T.; Hamashima, Y.; Kan, T. Eur. J. Org. Chem. 2013, 30, 6789. DOI: 10.1002/ejoc.201301065
- Fujiwara, H.; Kurogi, T.; Okaya, S.; Okano, K.; Tokuyama, H. Angew. Chem. Int. Ed. 2012, 51, 13062. DOI: 10.1002/anie.201207307
相关书籍
[amazonjs asin=”0198556640″ locale=”US” title=”Oxidation and Reduction in Organic Synthesis (Oxford Chemistry Primers)”][amazonjs asin=”3527323201″ locale=”US” title=”Modern Oxidation Methods”][amazonjs asin=”1441936424″ locale=”US” title=”Oxidation of Alcohols to Aldehydes and Ketones: A Guide to Current Common Practice (Basic Reactions in Organic Synthesis)”]外部リンク
- AZADO (organic-chemistry.org)
- ABNO (organic-chemistry.org)
- nor-AZADO (organic-chemistry.org)
- 東北大学大学院 岩淵好治研究室
- AZADO酸化マニュアル
- TEMPOよりも高活性なアルコール酸化触媒(TCI)
- 超高活性 酸化触媒nor-AZADO (和光純薬)
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载



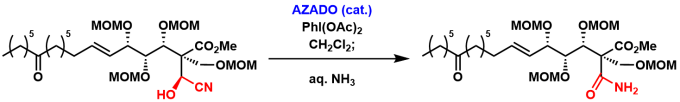















No comments yet.