本文投稿作者 alberto-caeiro
作者开发了一种分子内经由自由基环化的形式Heck反应,该反应所用底物为烷基溴,反应具有优秀的选择性,并且分子间的反应也可进行。
背景
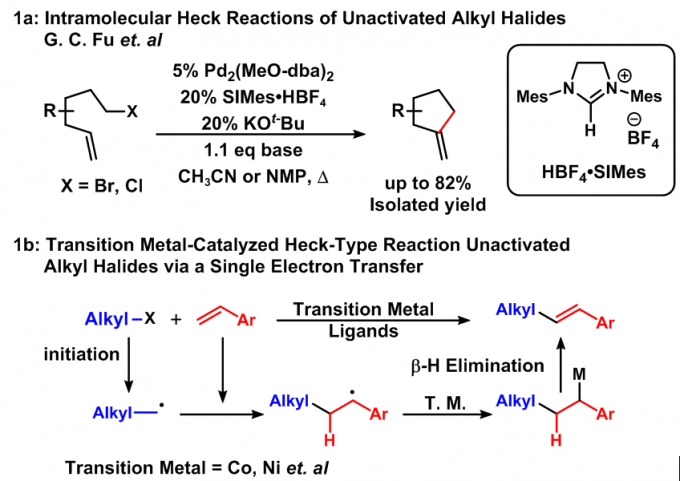
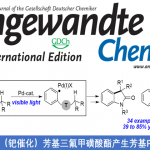
过渡金属催化的C-C键的构建因为相较于传统的C-C键构建方法有许多的优越性,越来越受到现代有机合成家们的青睐。其中应用广泛且可信任的反应是金属催化的交叉偶联反应和Mizoroki-Heck反应。亲电试剂通过这些反应可与各种亲核试剂、烯烃和炔烃连接起来,如:Kumada反应(格氏试剂)、Suzuki反应(有机硼试剂)、Stille反应(有机锡试剂)、Negishi反应(有机锌试剂)、Hiyama反应(有机硅试剂)等,从而高效合成传统化学难以合成的C-C键。此类反应虽然有极高的价值,但亲电试剂的范围有限,大多为芳基或烯基的卤化物和磺酸酯,过渡金属催化的烷基亲电试剂C-C键构建则难以进行。G. C. Fu在2007年发表了第一例钯催化烷基卤代物的Heck反应(1a),但烷基卤代物的范围限定在了一级[1]。而过渡金属催化的自由基参与的形式Mizoroki-Heck反应则有一些报道[2](1b)。
图1:已有报道的烷基卤代物的Mizoroki-Heck-Type反应
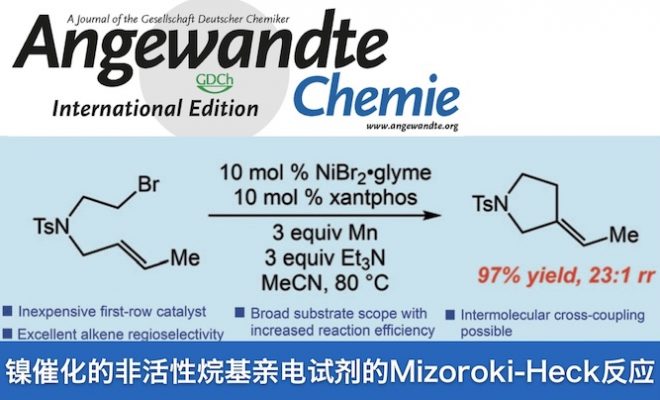
本工作介绍了一种镍催化烷基溴发生形式上的Mizoroki-Heck反应。此反应的条件温和,对一级、二级烷基溴都有好的兼容性,且分子间的交叉偶联反应也可进行。反应的烯烃也有一定选择性。机理研究表明:反应是直接的碳环化反应,而非之前钯自催化的原子转移环化反应。
Nickel-Catalyzed Mizoroki-Heck-Type Reactions of Unactivated Alkyl Bromides”
Megan R. Kwiatkowski, Erik J. Alexanian
Angew. Chem. Int. Ed., 2018,57,16857., doi.org/10.1002/anie.201810757.
工作介绍
2018年,Erik J. Alexanian实现了金属镍催化非活化烷基溴的Mizoroki-Heck-Type反应(图2),相对与钯催化剂,反应对烯烃的选择性有较大的增强。机理上是自由基的直接环化,而不是此前的原子转移自由基环化过程。
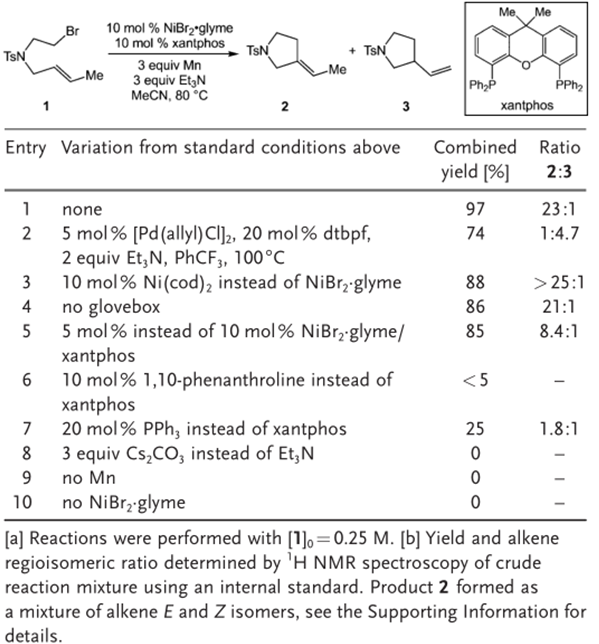
在条件优化表(图2)中,由entry2和3知,钯催化剂在烯烃生成的选择性上较差,而Ni(COD)2催化反应的收率有所下降。由entry5知,催化剂的量下降会使收率稍显下降,但选择性有明显的下降。由entry5和6知,PPh3和1,10-二氮杂菲对反应的催化性能极差。当选择使用无机碱Cs2CO3,不添加单质锰和不加NiBr·glyme时,反应都不能发生。有趣的是,反应不在手套箱的Ar气氛围下也有不错的收率和选择性。
图2:条件优化表
在优化后的模板条件下,对反应底物范围进行了拓展(图3,4)。一级烷基溴能顺利地和双取代、三取代烯烃 (entry1-6),β-苯乙烯(entry7)和端烯发生反应,在良好到优秀的烯烃选择性下,得到5元碳环或杂环。该反应还可用于得到双环骨架(entry9, 10),该双环骨架还可为极具合成优势的螺环骨架。二级烷基溴也是一个可行的反应底物,双四氢呋喃产物23即是通过二级溴高选择性得到的(entry11)。除5元环外,6元环也可通过此条件得到(entry12)。
图3:分子内反应底物范围
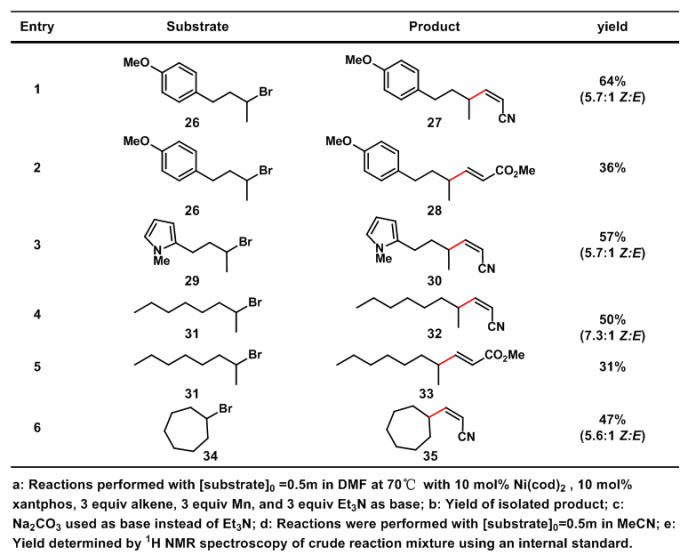
随后,作者对分子间的反应进行了探索。虽然金属钯催化烷基卤代物的分子间Heck-Type反应已有很多报道,但金属镍催化的反应却鲜有报道。烷基溴26能以中等收率得到产物27和28(entry1, 2)。N-甲基吡咯衍生物29也同样反应得到产物(entry3)。简单烷烃的溴化物也能以一般的收率得到相应的产物(entry4, 5)。环状的二级烷基溴也能发生反应,得到中等收率的产物。
图4:分子间反应底物范围
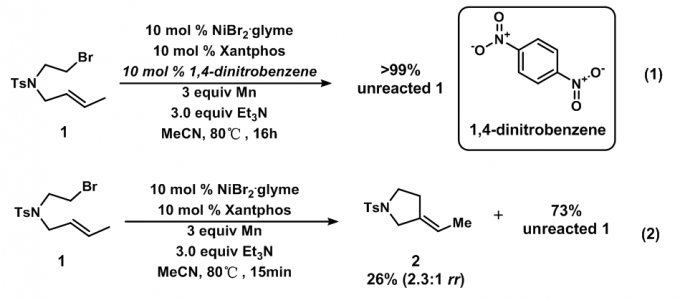
机理方面,文章思路与2017年的JACS相类似,将反应在部分反应时停止下来,观测反应中间体的情况。最后发现,15min反应的产物只有目标产物和未反应的原料,但产物的选择性较差(2.3:1 dr),如图13。在单电子转移抑制剂的存在下,反应不能进行。因此推测了一种可行的机理(图5)。
图5:反应机理研究
Ni(0)与烷基溴发生单电子转移生成自由基物种,随后发生自由基环化反应生成的另一自由基和Ni(l)结合生成烷基镍物种,随后在碱的作用下发生β-H消除得到产物。Ni-HBr物种对烯烃的异构化作用对反应选择性有重要作用。
图6:推测的机理
参考文献
- Firmansjah, L.; Fu, G. C. J. Am. Chem. Soc.,2007, 129,11340–11341.DOI: 10.1021/ja075245r.
- Affo,W.; Ohmiya, H.; Fujioka, T.; Ikeda, Y.; Nakamura, T.; Yorimitsu, H.;Oshima, K.; Imamura, Y.; Mizuta, T.; Miyoshi, K. J. Am. Chem. Soc.,2006,128, 8068–8077. DOI: 10.1021/ja061417t.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!

















No comments yet.