本文作者:孙苏赟
1.手性胺类催化剂
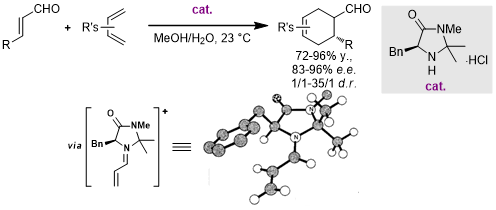
在2000年,MacMillan课题组报道了第一例不饱和醛和二烯的不对称DA反应,其中使用手性仲胺作为催化剂来降低了亲双烯体的LUMO使得反应顺利进行[1]:
在此之后,多个类似的仲胺催化剂都被证明在DA反应中非常高效[2,3],
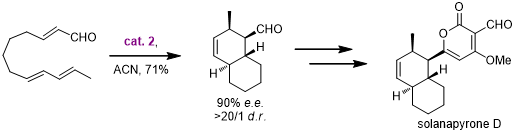
此方法还被应用到了Solanapyrone D的全合成中:
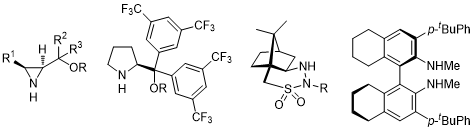
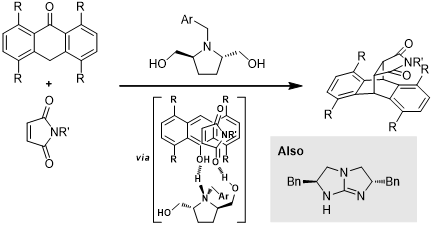
基于以上的仲胺催化剂的不对称催化原理,后人又开发出几类仲胺催化剂[4-8]:
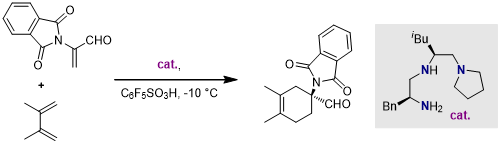
除了上述的仲胺催化剂可以实现不对称的DA反应,一些伯胺催化剂也可以得到不错的效果。在2005年,Ishihara课题组报道了以一种大位阻伯胺为催化剂催化的不对称DA反应[9, 10]:
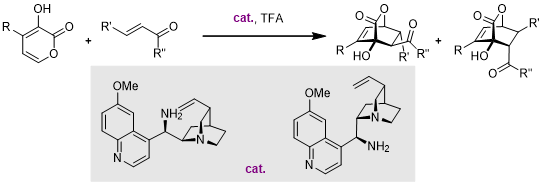
而到了2008年,Deng课题组报道了一例金鸡纳碱衍生物催化的不对称DA反应,反应中主要的参与片段是手性伯胺[11]:
2.Brønsted酸类催化剂
在有机催化的Diels-Alder的反应中,常常进行手性Brønsted酸催化剂和手性Lewis酸的比较[12-14]。首例手性Brønsted酸催化的由Göbel课题组于2000年报道,用于合成在途化合物,但是反应的e.e.值很低[15]:
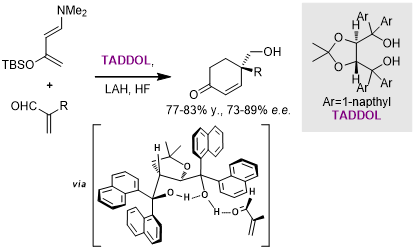
之后,Rawal课题组报道了一例利用TADDOL作为手性Brønsted酸催化剂,以较高立体选择性的实现的的DA反应[16]:
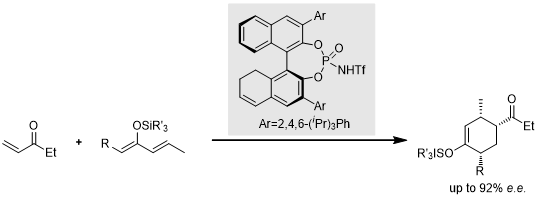
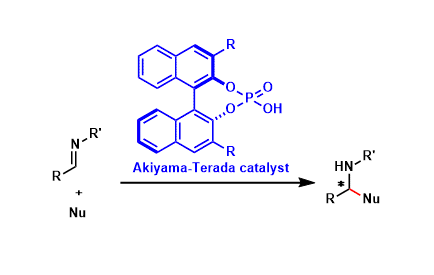
基于以上氢键活化的思路,Yamamoto开发出一类BINAP衍生物类催化剂,实现了较高立体化学选择性[17]:
3.双功能催化剂
Yomomato开发出一种C2对称的手性叔胺催化剂,可以87% ee值的DA反应,从反应过渡态可看出,催化剂可以于双烯体和亲双烯体之间发生双重的相互作用以指导两者进行加成反应的立体化学选择性:
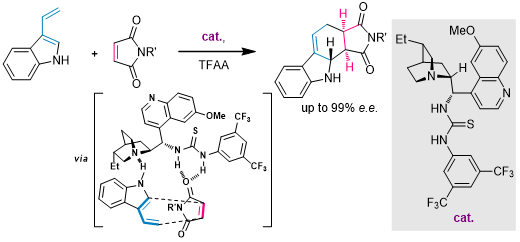
之后Bernardi课题组又开发出金鸡纳碱衍生的硫脲催化剂,反应可以以不错的收率获得非常高的立体化学选择性[18]:
References
1.J. Am. Chem. Soc. 2000, 122, 17, 4243–4244. DOI: 10.1021/ja000092s
2.J. Am. Chem. Soc. 2005, 127, 33, 11616–11617. DOI: 10.1021/ja054008q
3.J. Am. Chem. Soc. 2002, 124, 11, 2458–2460. DOI: 10.1021/ja017641u
4.Org. Lett., 9, 2859–2862. DOI: 10.1021/ol071009+
5.Angew. Chem. Int. Ed., 47,6634–6637. DOI: 10.1002/anie.200801408
6.Org. Lett., 10, 2421–2424. DOI: 10.1021/ol8005826
7.Tetrahedron Lett.,49, 5576–5579. DOI: /10.1016/j.tetlet.2008.07.012
8.Org. Lett., 8, 2687–2689. DOI: 10.1021/ol060621i
9.Org. Lett. 2008, 10, 13, 2893–2896. DOI: 10.1021/ol8011277
10.J. Am. Chem. Soc. 2005, 127, 30, 10504–10505. DOI: 10.1021/ja053368a
11.J. Am. Chem. Soc. 2008, 130, 8, 2422–2423. DOI: 10.1021/ja078251w
12.Angew. Chem. Int. Ed., 45, 1520–1543. DOI: 10.1002/anie.200503132
13.Chem. Rev., 107, 5713–5743. DOI: 10.1021/cr068373r
14.Chem. Rev., 107, 5744–5758. . DOI: 10.1021/cr068374j
15.Org. Lett. 2000, 2, 2, 179–181. DOI: 10.1021/ol991276i
16.Proc. Natl. Acad. Sci. U.S.A., 101, 5846–5850. DOI: 10.1073/pnas.0308545101
17.J. Am. Chem. Soc. 2006, 128, 30, 9626–9627. DOI: 10.1021/ja062508t
18.Angew. Chem. Int. Ed. 2008, 47, 9236 –9239. DOI: 10.1002/anie.200804275
















No comments yet.