芳香亲电取代反应是芳香族化合物的代表性的反应。由于该反应常常出现在教科书中,所以是非常基础的反应,而这里小编再次总结归纳一下,方便读者们,尤其主要针对刚刚进入大学的童鞋们。该章节小编打算分成两部分来讲。上篇主要介绍以苯为底物的芳香族取代反应,而下篇介绍一下苯酚的导向性的取代反应,并且主要重点介绍下反应机理。
苯与苯酚溴代反应的不同之处
首先,下图中给出了苯与苯酚的溴代反应的scheme
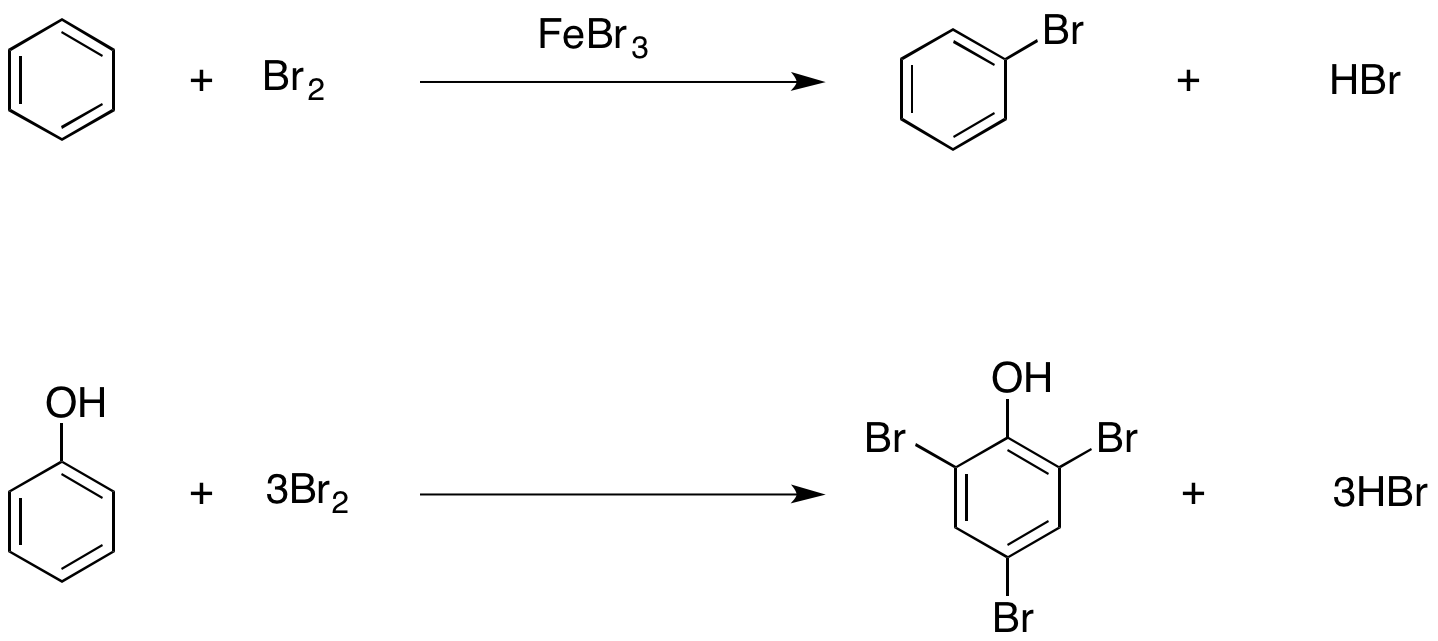
首先我们从反应产物看起,从图中可以看出,苯环上发生了单溴代反应,而相对的,苯酚的话分别在邻位与对位都发生了溴取代反应。虽然说上面的式子中明确标记了苯酚是与3当量的溴进行的反应,可能会有人说那肯定是能上三个溴么,一点都不奇怪呀。但是,当假设苯酚与两当量的溴混合的话,主要产物还是三溴代的苯酚。但是,如果加入超过3当量,不管过剩多少,也不会得到间位溴代产物。这个小编会在下一篇中进行解释。
接下来,我们关注下反应条件。苯的反应在Lewis 酸FeBr3 的条件下进行,如果不加这个催化剂的话,溴代反应是不会发生的。而反观苯酚,无需添加任何催化剂,就能进行三次溴代得到三溴代产物。
总结下上述,苯与苯酚的反应性的差异可能会产生以下两点疑问。
- 为什么苯与苯酚的反应性差距这么大。(催化剂的必要性)
- 为什么苯酚的溴代发生在o,p 位 。也就是说为什么仅仅 m 位不反应。(导向性)
而小编所说的对于芳香亲电取代反应的上下两篇也就是围绕这两个疑问进行解答。这一次,主要讲解下苯的亲电取代反应的机理。
苯环的溴代反应是如何进行的
一般的苯环的取代反应主要分为以下三个步骤。
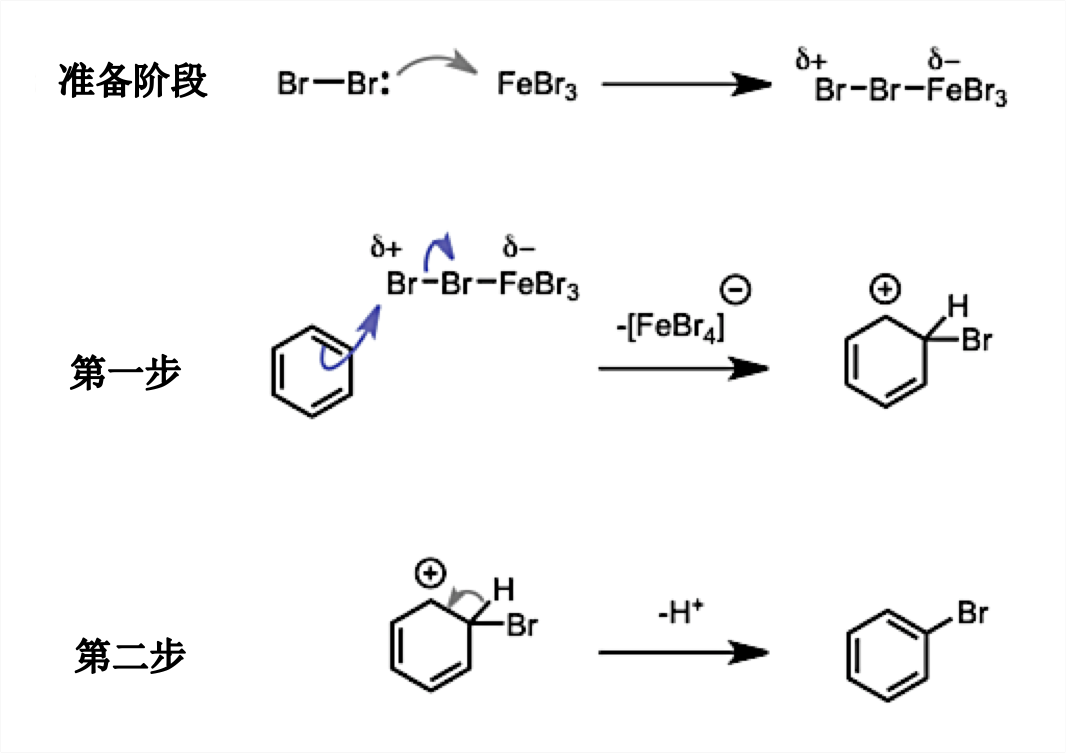
以下是对每个步骤的及简单说明。
准备阶段《起始阶段》 : 生成强亲电试剂。
第一阶段 : 苯环上的 π 电子进攻溴,继而生成非芳香性的碳正离子中间体,同时,溴离子与铁形成配合物离去
第二阶段 : 碳正离子中间体邻位的C-H的 σ 键的电子导入碳正离子,放出proton重新得到芳香性的溴代苯产物完成反应。
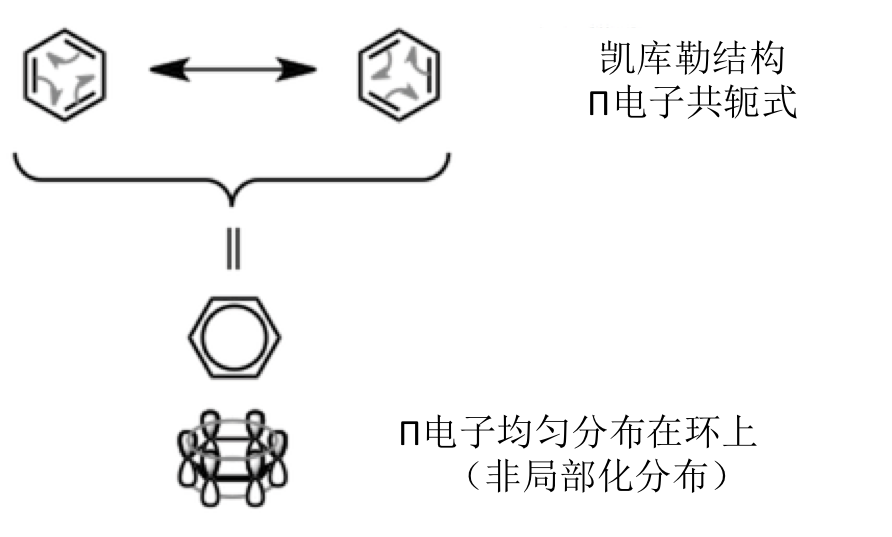
而大家都有一个基本的常识,就是苯环的π电子系是均匀分布在整个环上的,是十分稳定的电子系。
而他的稳定性,如下图所示可以用凯库勒共振结构式表示,而它的π电子的均匀分布及芳香特性也可以从最下面的π轨道的相互共轭中看出。
而回到上述的反应机理,我们可以看出首先苯环的芳香性是被破坏的,而由于芳香性是非常稳定的特性,所以最终有重现了芳香性得到了稳定的溴代苯产物。而破坏底物的芳香性,在这个反应中是通过与非常强力的亲电试剂反应达成的。而强亲电试剂的形成,是Br2的孤对电子进入Fe的空轨道中形成了与铁的配合物,使得Br2的σ 键朝Fe的方向倾斜,从而得到了所述的强有力的亲电试剂。进而,把稳定的苯环的π电子引出,进行第一步的反应。所以在这个反应中像FeBr3这样的Lewis算是必须的。
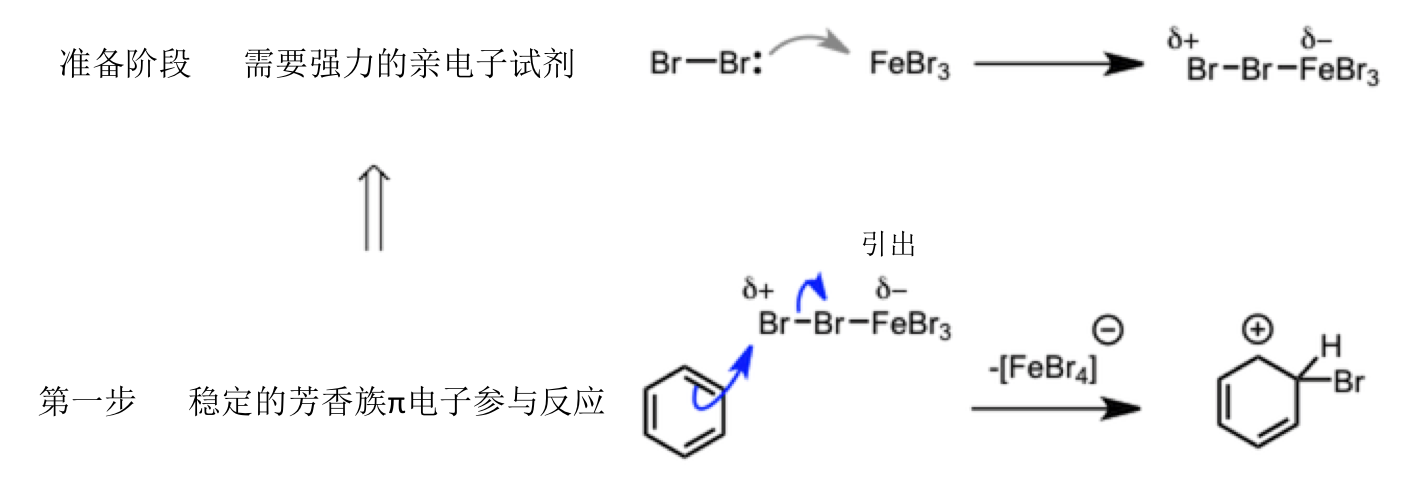
第一步中产生的中间体碳生栗子,可以画成下图所示的共振结构式。也就是说正电荷是可分散的,从而提高了该碳正离子的稳定性。但是原来含有的芳香性被破坏这一事实是无法改变的,因此相比于原来底物那肯定是不稳定的。因此为了重新回到稳定的芳香性构造,邻C-Hσ键的电子导向碳正离子,并放出proton进行芳香性重铸得到产物。
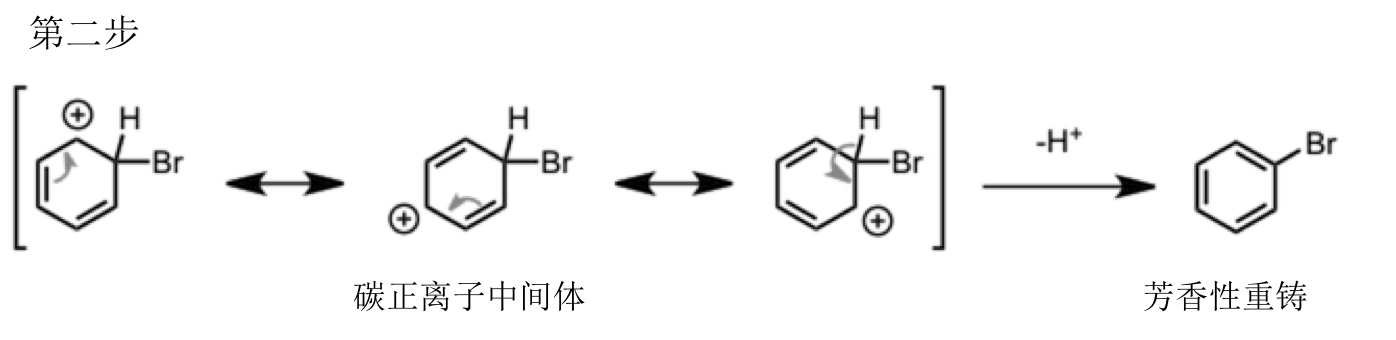
π 电子的强行引出
本次的反应机理需要记住的是: 本来非常稳定的苯环,在强力的亲电子试剂的作用下,进行了取代反应。
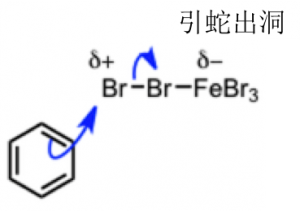
简单的归纳就是如上图所示。这里最终要的就是Br2与Lewis酸FeBr3形成配合物时,电子是流向Fe的,所以Br上应该是显示的电正性,这个非常重要。这也是阐释了Lewis酸的作用机理。
其他的芳香性亲电取代反应有,苯环的硝基化,磺酸化,Friedel-Crafts烷基化,酰基化反应等。这些反应的机理也都是非常类似的,有兴趣的可以点击链接进行对比。最后,一如既往地,下表中小编归纳了一些芳香亲电取代反应,供大家参考(可以直接点击反应名查看反应)。
| 反应名 | 关键步骤 | 备注 |
| 芳香族卤代反应 |  |
|
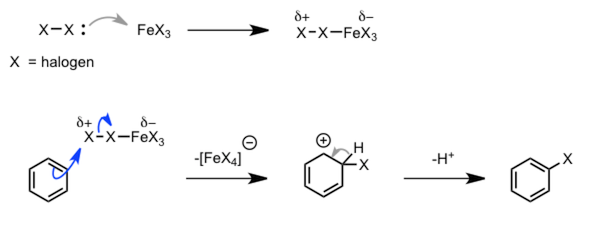 |
||
| 芳香族化合物硝基化反应 |  |
通过强酸作用,硝酸脱水,形成强吸电子的硝基正离子。 |
 |
||
| 芳香族化合物的磺酸化 |  |
反应可逆,在稀酸水溶液中进行加热,可以进行脱磺酸反应。 |
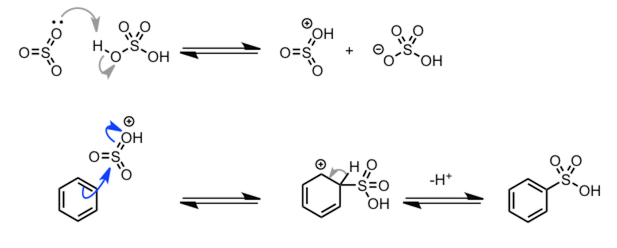 |
||
| Friedel-Crafts烷基化 |  |
碳正离子是活性种。 |
 |
||
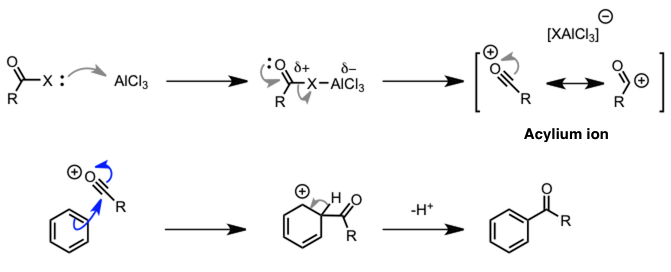
| Frieden-Crafts酰基化反应 |  |
酰基正离子是活性种。 |
 |
||
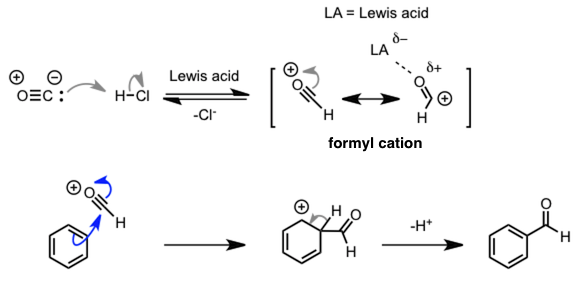
| Gattermann-Koch 反应 |  |
通过一氧化碳的质子化生成甲酰正离子作为亲电子试剂参与反应。 |
 |
||
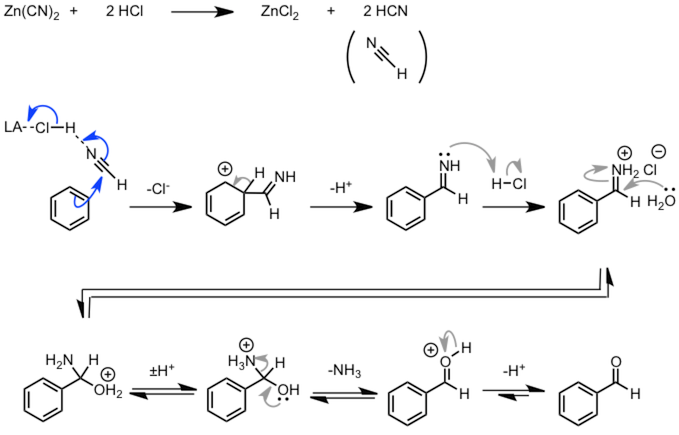
| Gattermann 醛合成 |  |
Gatterman-Koch 反应的改良。氰化锌与盐酸反应,在体系中形成氢氰酸发生取代反应。之后亚胺再通过水解得到醛。 |
 |
||
| Pictet-Spengler反应 |  |
|
 |
||
相关动画





















No comments yet.