本文作者:杉杉
导读
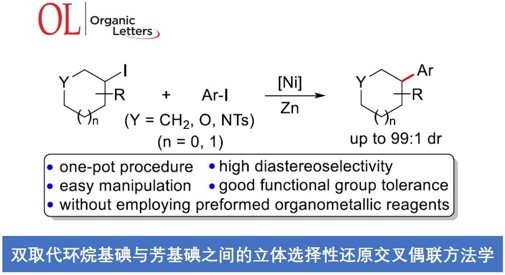
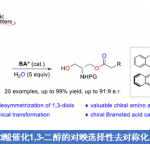
南京工业大学的沈志良等研究团队合作报道一种通过镍催化剂促进的双取代环烷基碘与芳基碘之间的直接还原交叉偶联反应方法学。这一全新的一锅还原交叉偶联策略具有操作简便、底物应用范围广泛以及高度的官能团兼容性等优势。此外,这一策略中,同样能够表现出优良的立体选择性。
Nickel-Catalyzed Diastereoselective Reductive Cross-Coupling of Disubstituted Cycloalkyl Iodides with Aryl Iodides
X. Song, M. Guo, S. Xu, C. Shen, X. Zhou, X. Chu, M. Ma, Z. Shen,
Org. Lett. 2021, 23, 5118. doi: 10.1021/acs.orglett.1c01649.
正文
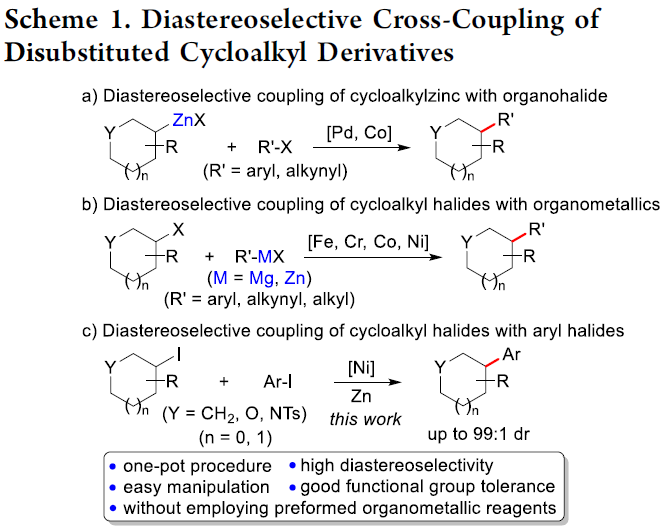
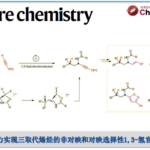
有机分子的立体选择性合成在学术界与工业界中均具有最为重要的研究价值。其中,采用过渡金属试剂促进的立体选择性交叉偶联反应方法学,已经成功应用于具有多重立体生成中心的有机分子的构建。例如,Knochel等[1]报道通过钯或钴催化的双取代环烷基锌试剂与芳基或炔基卤之间的高度立体选择性交叉偶联反应策略,进而成功完成带有两重立体生成中心的双取代环烷基化合物的 构建 (Scheme 1a)。并且,研究表明,在铁、铬、钴或镍催化剂存在的条件下,通过双取代环烷基卤与芳基、烷基或炔基金属有机试剂之间的非对映选择性交叉偶联策略,同样能够有效地完成双取代环烷基化合物的立体选择性构建 (Scheme 1b)[2]。然而,上述策略存在一定程度的局限性,例如,需要预先制备各类对于湿气较为敏感的金属有机试剂。因此,上述策略缺乏一定的步骤经济性与实验室操作的简洁性。由此,作者设想,如果能够通过高度立体选择性的方式,直接实现双取代环烷基卤与芳卤之间的直接交叉偶联反应过程,则能够进一步使实验室操作更为简洁,并且更加具有合成应用价值。
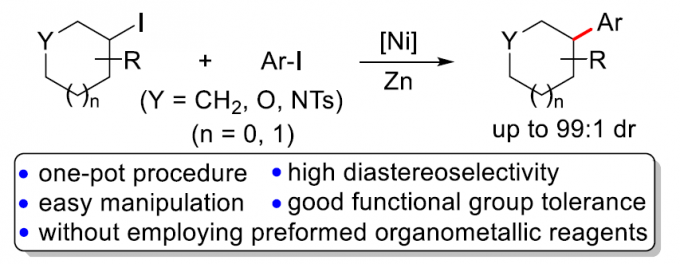
近年来,诸多课题组已经成功设计出采用过渡金属催化剂促进的两种不同类型的亲电有机卤代物之间的还原交叉偶联方法学[3]。这一类型的一锅反应策略能够有效地避免采用缺乏稳定性或较难制备的有机金属试剂。然而,将这一策略应用于涉及二取代环烷基卤代物参与的非对映选择性还原交叉偶联过程,却较少有文献报道[4]。在此,本文将报道一种采用镍催化剂促进的双取代环烷基碘与芳基碘之间的直接还原交叉偶联反应方法学,进而获得具有高度非对映选择性的交叉偶联产物 (Scheme 1c)。
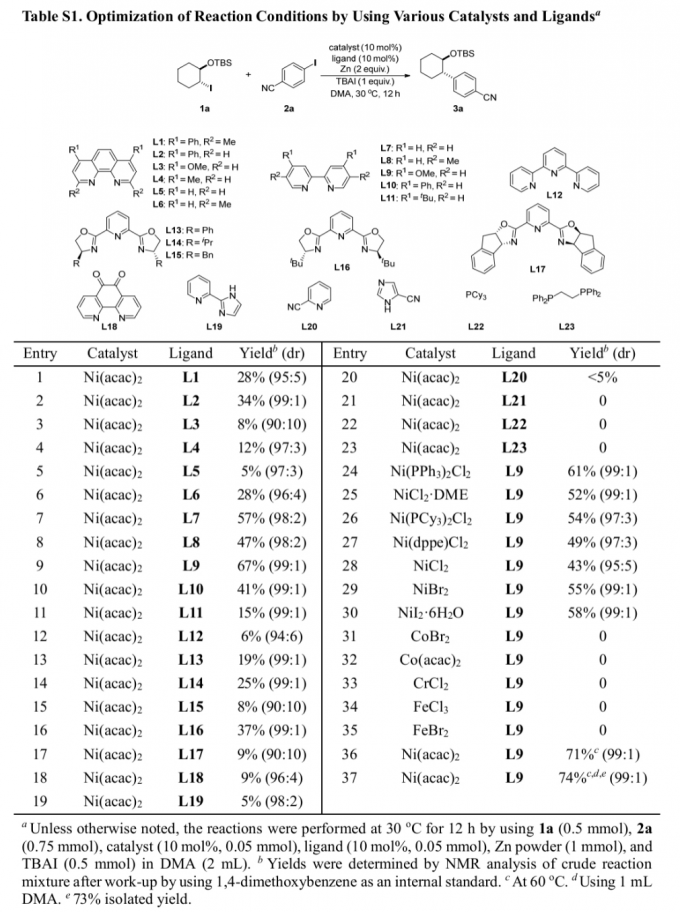
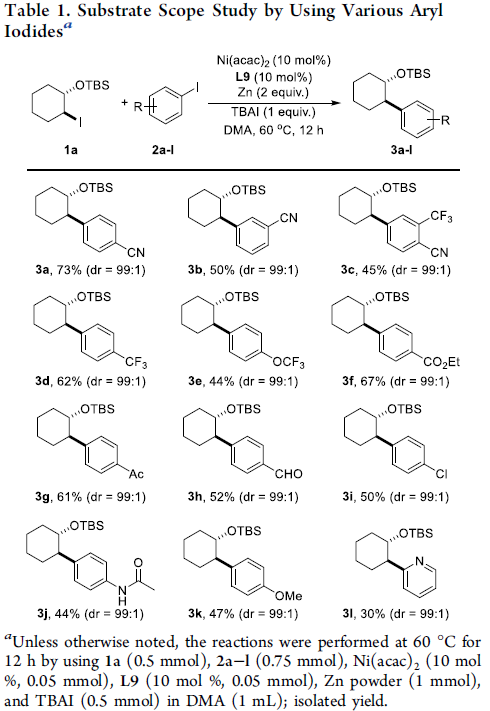
首先,作者采用双取代环己基碘1a与4-碘苯腈2a作为模型底物,进行相关偶联反应条件的优化筛选 (Table S1)。进而确定最佳的反应条件为:采用Ni(acac)2作为催化剂,L9作为配体,Zn粉作为还原剂,DMA作为反应溶剂,TBAI作为添加剂,反应温度为60 oC,反应时间为12h,进而获得74%收率的交叉偶联产物3a,dr为99:1。
在获得上述的最佳反应条件之后,作者开始对芳基碘底物2的应用范围进行考察 (Table 1)。研究表明,芳环中具有不同基团取代的芳基碘底物,均能够与1a顺利进行反应,并获得相应的还原偶联产物3a–3k,收率44-73%,dr均为99:1。同时,作者发现,对于芳环中带有氯原子取代的芳基碘底物,上述反应条件能够化学选择性地在C-I反应位点进行相应的偶联过程。尤其值得注意的是,这一全新的立体选择性还原偶联策略具有良好的官能团兼容性,对于芳基碘底物中存在的酯基、醛基、卤素等官能团,均能够良好地进行兼容。此外,具有吡啶基取代的杂芳基碘底物2l,同样能够较好地参与上述的交叉偶联过程,尽管产物3l的收率相对较低。
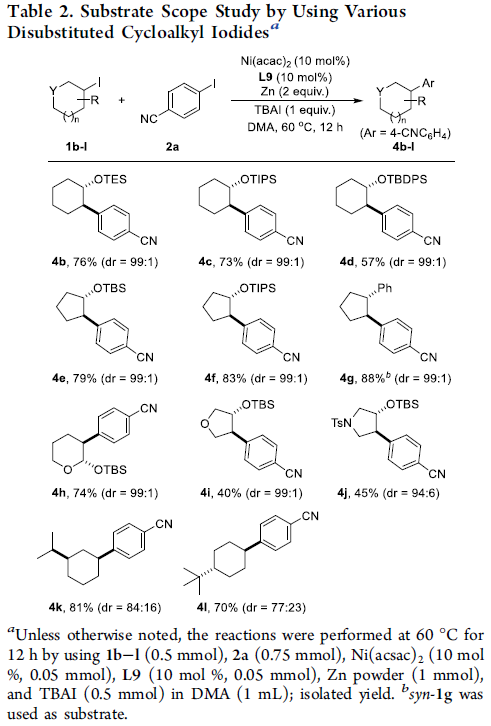
之后,作者对二取代环烷基碘底物1的应用范围进行深入研究 (Table 2)。作者发现,具有各类硅烷基保护的六元环trans-碘代醇底物1b–1d,均能够与2a顺利反应,并以57-76%的收率获得产物4b–4d,dr均为99:1。同时,作者观察到,采用硅烷基保护的五元环trans-碘代碘醇底物1e–1f,同样能够获得相应目标产物4e–4f。有趣的是,具有syn-构型的底物1g,在上述的标准反应条件下,却能够以良好的反应收率获得热力学更为有利的trans-产物,进而表明这一全新的立体选择性还原偶联过程中可能涉及自由基中间体。同时,该小组进一步发现,具有四氢吡喃、四氢呋喃以及吡咯烷结构单元的trans-杂环碘代醇底物1h–1j,同样能够较好地完上述的还原偶联过程,并以40-74%的收率与良好的立体选择性获得相应目标产物4h–4j。此外,1,3-二取代环己基碘1k与1,4-二取代环己基碘1l在上述的标准反应条件下,同样能够有效地参与上述的还原偶联过程,并以良好的收率与中等程度的非对映选择性,获得预期的偶联产物4k与4l。
有趣的是,具有烯丙醚基团取代的环烷基碘底物5a–5b,在上述的最佳反应条件下,同样能够与2a顺利进行反应,并分别获得六氢-4H-呋喃并[2,3-b]吡喃6a (78%收率,90:10 dr)以及六氢呋喃并[2,3-b]呋喃6b (78%,dr为97:3) (Scheme 3)。类似地,具有烯丙醚基团取代的芳基碘底物5c,同样能够有效地与2a进行相应的偶联过程,并获得48%收率的2,3-二氢苯并呋喃产物6c。值得注意的是,通过串联环化/偶联的反应策略,能够进一步完成各类广泛存在于天然产物或生物活性分子中的双环结构单元的构建。
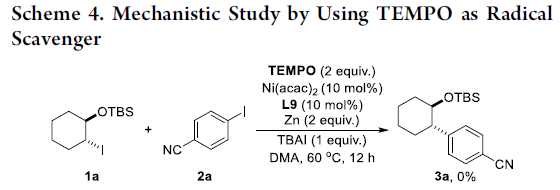
同时,作者发现,1a与2a在上述标准条件下进行反应时,加入自由基捕获剂TEMPO,则无法获得相应的还原交叉偶联产物。这一结果表明,上述的还原交叉偶联反应过程涉及自由基中间体 (Scheme 4)。
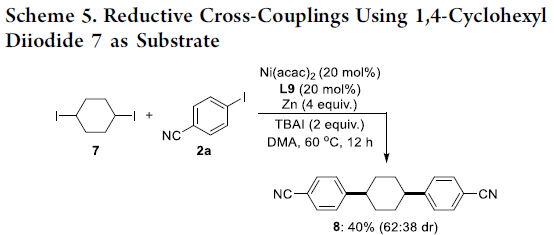
之后,作者发现,采用1,4-二碘环己烷7作为反应原料时,在上述的最佳反应条件下与2a作用,能够获得相应的双偶联产物8,收率为40%,dr为62:38 (Scheme 5)。
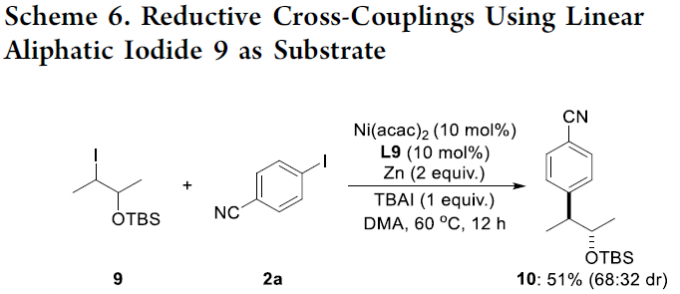
此外,采用相邻位置带有OTBS基团取代的线性脂肪族碘代底物9时,在上述的最佳反应条件下与2a作用,能够获得偶联产物10,收率为51%,dr为68:32 (Scheme 6)。
根据上述研究以及前期的文献报道[3e]-[3f], [5],作者推测,在这一全新的立体选择性还原交叉偶联反应过程中,可能涉及自由基链机理 (radical chain mechanism)双重氧化加成机理 (double oxidative addition mechanism)。即反应机理类似于在化学计量的锌粉或锰粉存在下,采用镍(II)盐催化的烷基卤与芳基卤之间的还原交叉偶联反应。此外,多数情况下,反应过程中高度的非对映选择性控制可能源自于立体效应。
总结
本文主要报道一种采用Ni(acac)2作为催化剂,4,4′-二甲氧基-2,2′-联吡啶作为配体,锌粉作为还原剂,TBAI作为添加剂的反应体系,成功实现双取代环烷基碘与芳基碘之间的直接还原交叉偶联反应方法学,进而获得优良非对映选择性的偶联产物。同时,这一全新的立体选择性还原偶联策略具有实验操作简洁、底物应用范围广泛以及高度的官能团兼容性等优势。此外,这一偶联策略同样能够进一步应用于一系列重要双环砌块的构建,例如呋喃并吡喃、呋喃并呋喃以及苯并呋喃。
参考文献
[1] (a) T. Thaler, B. Haag, A. Gavryushin, K. Schober, E. Hartmann, R. M. Gschwind, H. Zipse, P. Mayer, P. Knochel, Nat. Chem. 2010, 2, 125. doi: 10.1038/nchem.505.(b) T. Thaler, L. Guo, P. Mayer, P. Knochel, Angew. Chem. Int. Ed. 2011, 50, 2174. doi: 10.1002/anie.201006879.
[2] (a) H. Gong, R. Sinisi, M. R. Gagné, J. Am. Chem. Soc. 2007, 129, 1908. doi: 10.1021/ja068950t.(b) H. Gong, M. R. Gagné, J. Am. Chem. Soc. 2008, 130, 12177. doi: 10.1021/ja8041564.
[3] (a) J. Liu, Y. Ye, J. L. Sessler, H. Gong, Acc. Chem. Res. 2020, 53, 1833. doi: 10.1021/acs.accounts.0c00291.(b) J. Gu, X. Wang, W. Xue, H. Gong, Org. Chem. Front. 2015, 2, 1411. doi: 10.1039/C5QO00224A.
(c) D. J. Weix, Acc. Chem. Res. 2015, 48, 1767. doi: 10.1021/acs.accounts.5b00057.
(d) W. M. Czaplik, M. Mayer, A. J. von Wangelin, Angew. Chem. Int. Ed. 2009, 48, 607. doi: 10.1002/anie.200804434.
(e) D. A. Everson, B. A. Jones, D. J. Weix, J. Am. Chem. Soc. 2012, 134, 6146. doi: 10.1021/ja301769r.
(f) X. Wang, G. Ma, Y. Peng, C. E. Pitsch, B. J. Moll, T. D. Ly, X. Wang, H. Gong, J. Am. Chem. Soc. 2018, 140, 14490. doi: 10.1021/jacs.8b09473.
[4] (a) X. Yu, T. Yang, S. Wang, H. Xu, H. Gong, Org. Lett. 2011, 13, 2138. doi: 10.1021/ol200617f.(b) S. Wang, Q. Qian, H. Gong, Org. Lett. 2012, 14, 3352. doi: 10.1021/ol3013342.
[5] S. Biswas, D. J. Weix, J. Am. Chem. Soc. 2013, 135, 16192. doi: 10.1021/ja407589e.




















No comments yet.