本文作者:Summer
导读
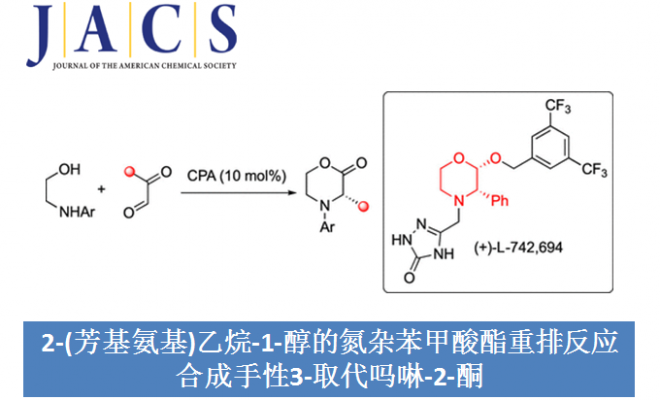
瑞士洛桑联邦理工学院祝介平教授成功报道了手性磷酸催化芳基乙二醛和非手性2-(芳基氨基)乙烷-1-醇发生氮杂苯甲酸酯重排反应,能以高收率和对映选择性得到一系列手性3-取代吗啉-2-酮。相关研究成果发表于Catalytic Enantioselective Synthesis of Morpholinones Enabled by Aza-Benzilic Ester Rearrangement
Yu-Ping He, Hua Wu, Qian Wang, and Jieping Zhu*,
J. Am. Chem. Soc. ASAP. DOI: 10.1021/jacs.1c03915
正文
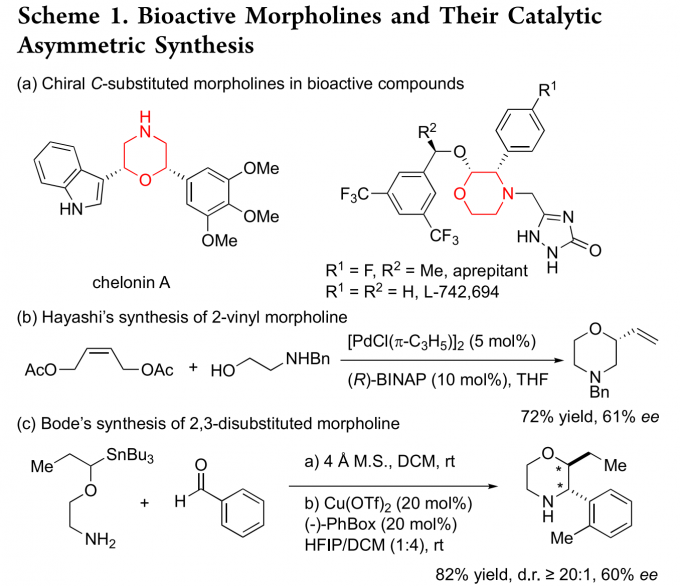
C-官能团化的吗啉/吗啉酮广泛存在于天然产物和药理活性的化合物中(Scheme 1a),同时,它们还可以作为手性配体用于不对称反应中。吗啉/吗啉酮的合成方法主要基于手性池策略,但关于不对称合成手性C-官能团化的吗啉/吗啉酮的报道仍然较为稀缺,且只有两例从头开始合成手性吗啉的报道,即Hayashi课题组报道的Pd-催化双烯丙基取代反应用于合成2-乙烯基吗啉[1](Scheme 1b)以及Bode课题组利用SnAP策略来合成2,3-二取代的吗啉[2](Scheme 1c)。
(图片来源:J. Am. Chem. Soc.)
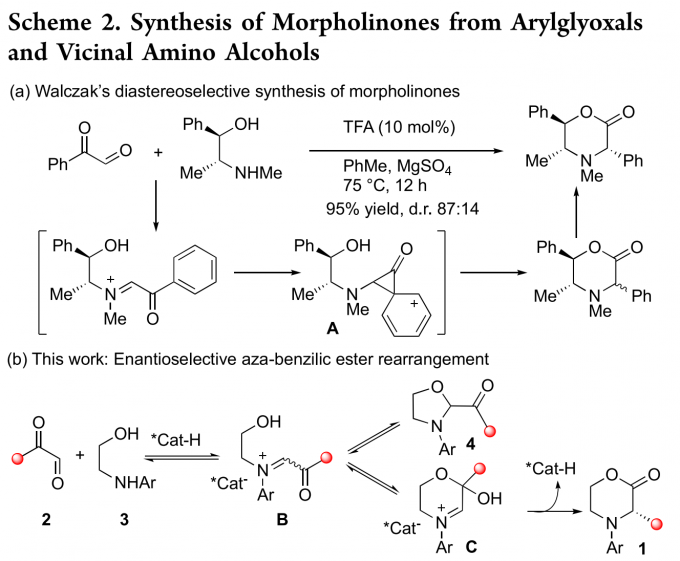
众所周知,芳基乙二醛与邻氨基醇反应可生成2-酰基氧唑烷。在酸性条件或较长存放时间下,这些噁唑烷可异构为相应的吗啉酮。基于此,Merck团队将噁唑烷转化为相应的3-(4-氟苯基)吗啉-2-酮[3]。随后,Walczak课题组则利用手性的邻氨基醇作为反应物成功实现了C-取代吗啉酮的非对映选择性合成[4](Scheme 2a)。基于上述背景研究,瑞士洛桑联邦理工学院祝介平教授成功报道了手性磷酸催化芳基乙二醛2和非手性2-(芳基氨基)乙烷-1-醇3发生氮杂苯甲酸酯重排反应,能以高收率和对映选择性得到一系列3-取代吗啉-2-酮1。该反应的反应机理为:在手性磷酸催化作用下,2和3反应生产亚胺离子中间体B。B发生环化反应可转化为动力学稳定的噁唑烷4,该步骤是可逆的。此外,B可发生分子内半缩化反应生成半缩醛C。C发生不可逆的1,2-芳基/烷基迁移从而生成热力学稳定的3-取代吗啉-2-酮1。因此,在适当的条件下,化合物4可充当六元半缩醛C的储存容器即4转化为B,B再转化为半缩醛C。
(图片来源:J. Am. Chem. Soc.)
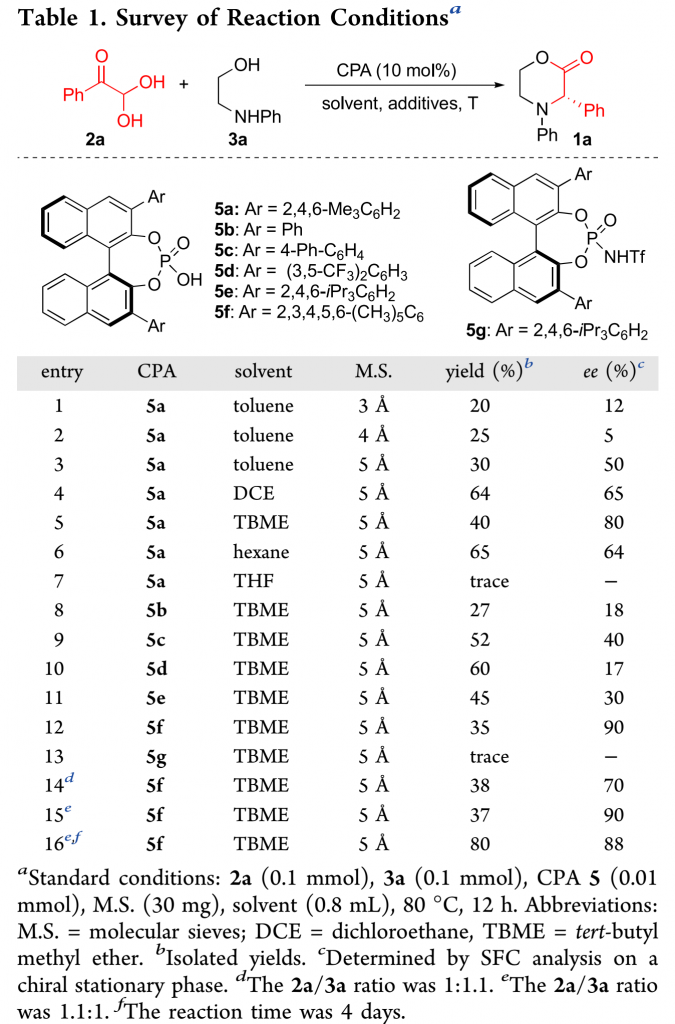
作者以苯乙二醛水合物2a和2-(苯氨基)乙-1-醇3a为模板底物,通过对催化剂、溶剂以及添加物等条件进行筛选,确定最优条件(Table 1)为:以10 mol% (S)-5f为催化剂,5Å分子筛为添加剂,TBME为溶剂,底物在80 °C条件下反应12 h,能以80%的收率和88%的对映选择性得到手性产物1a。
(图片来源:J. Am. Chem. Soc.)
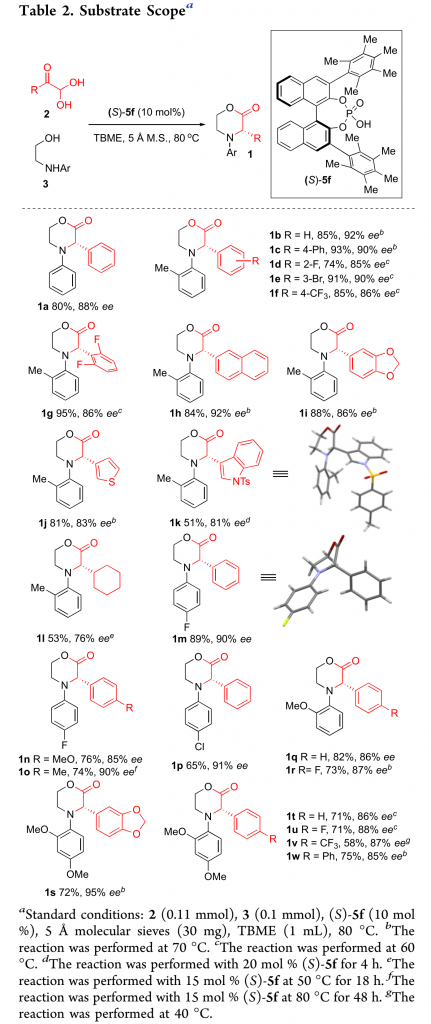
在最优反应条件下,作者对底物范围进行了考察(Table 2)。各种芳基、噻吩、N-甲苯磺酰基-3-吲哚取代的乙二醛以及各种芳基取代的乙醇均能较好的适应反应条件,并以良好至优秀的收率和对映选择性得到相应产物。但2-环己基-2-氧乙醛和2-(苄基氨基)乙烷-1-醇只能以适当的对映选择性得到相应产物。其中,1k和1m的绝对构型通过单晶确定。
(图片来源:J. Am. Chem. Soc.)
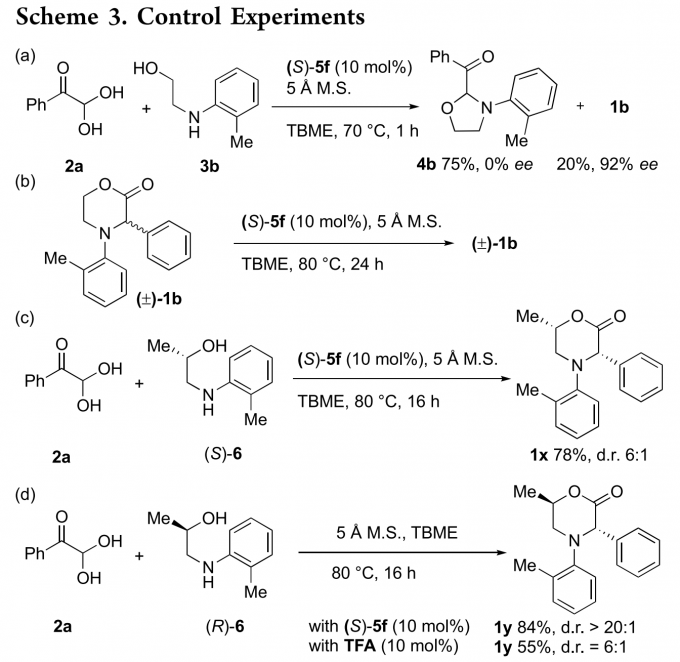
为了阐明反应机理,作者进行了一系列对照实验(Scheme 3)。标准反应条件下,2a与3b反应1小时,反应能以75%的收率得到1,3-恶唑烷4b,并以20%的收率和92%的ee值得到1b(Scheme 3a)。若将消旋的4b置于标准反应条件下,反应能以87%的收率和92%的ee值得到1b。这表明噁唑烷4b确实是手性吗啉酮1b的储存库。若将消旋的1b置于标准反应条件下反应24小时,反应只能得到消旋的产物1b(Scheme 3b)。这说明手性产物1b不是通过消旋的1b发生重排反应得到。标准反应条件下,手性氨基醇(S)-6与2a反应,反应能以78%的收率和6:1的非对映选择比得到手性产物1x(Scheme 3c)。手性氨基醇(R)-6与2a反应,反应能以84%的收率和20:1的非对映选择比得到手性产物1x(Scheme 3d)。若将催化剂换成三氟乙酸,反应的非对映选择比降至6:1。这些结果表明产物的对映选择性以及非对映选择性取决于催化剂。
(图片来源:J. Am. Chem. Soc.)
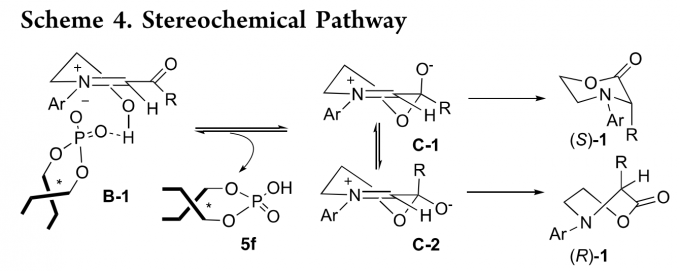
基于反应结果,作者假设亚胺离子B的优势构象为B-1,B-1与手性磷酸形成氢键,为下一步反应提供手性环境(Scheme 4)。B-1发生分子内半缩化反应生成
两个非对映异构体C-1和C-2。C-1发生1,2-芳基/烷基转移生成手性产物(S)-1。而从C-2进行的相同迁移将需要经历像小船一样的过渡态从而使芳基/烷基轨道和氮孤对电子重叠最大化,它在动力学上是不利的。
(图片来源:J. Am. Chem. Soc.)
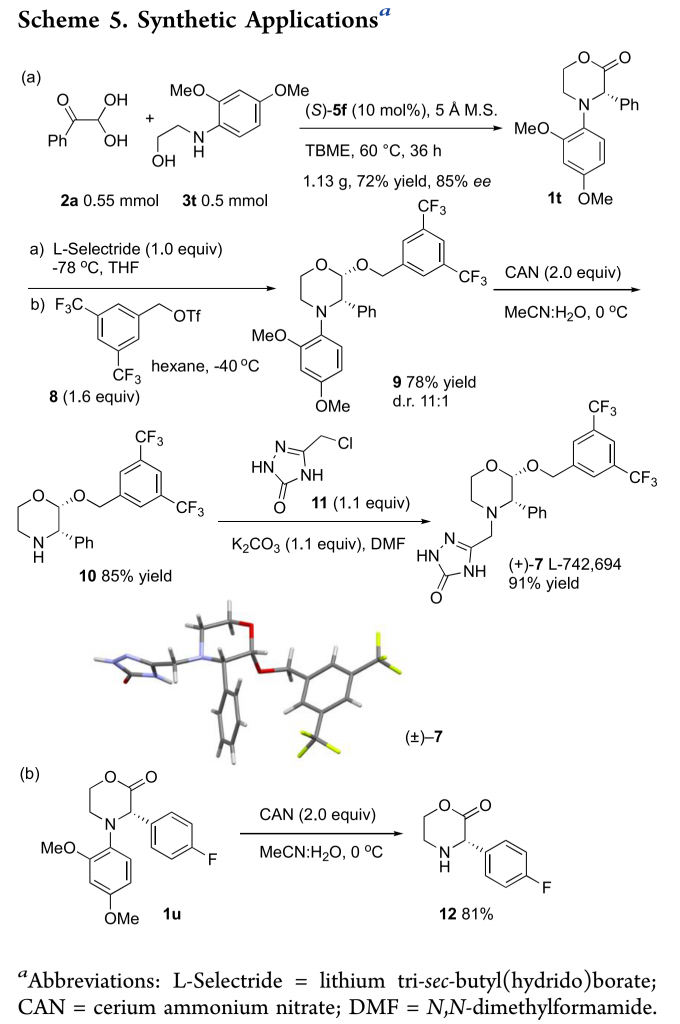
为了证明反应的应用潜力,作者进行了一系列衍生反应(Scheme 5)。首先,作者进行了扩大化反应,能以72%的收率和85%的ee值得到3-苯基取代的吗啉-2-酮1t。1t依次发生还原反应和烷基化反应,能以78%的收率和11:1的dr值得到cis–9。以硝酸铈铵为单电子转移试剂,cis–9的N-芳基脱保护转化为10。在碱性条件下,10与5-(氯甲基)-2,4-二氢-3H-1,2,4-三唑-3-酮11反应生成生物活性化合物吗啉衍生物L-742,694(7)(Scheme 5a)。此外,合成止吐药aprepitant的重要中间体(S)-3-(4-氟苯基)吗啉-2-酮(12)可通过1u转化而来。
(图片来源:J. Am. Chem. Soc.)
小结
瑞士洛桑联邦理工学院祝介平教授成功报道了手性磷酸催化芳基乙二醛2和非手性2-(芳基氨基)乙烷-1-醇3发生氮杂苯甲酸酯重排反应,能以高收率和对映选择性得到一系列手性3-取代吗啉-2-酮1。
参考文献
- Uozumi, A. Tanahashi, T. Hayashi, J. Org. Chem. 1993, 58, 6826-6832. DOI: 10.1021/jo00076a052
- U.Luescher, J. W. Bode, Angew. Chem., Int. Ed. 2015, 54, 10884-10888. DOI: 10.1002/anie.201505167
- M.Zhao, J. M. McNamara, G.-J. Ho, K. M. Emerson, Z. J. Song, D. M. Tschaen, K. M. J. Brands, U.-H. Dolling, E. J. J. Grabowski, P. J. Reider, l. F. Cottrell, M. S. Ashwood, B. C. Bishop, J. Org. Chem. 2002, 67, 6743-6747. DOI: 10.1021/jo0203793
- C.Powell, M. A. Walczak, J. Org. Chem. 2018, 83, 10487-10500. DOI: 10.1021/acs.joc.8b01516




















No comments yet.