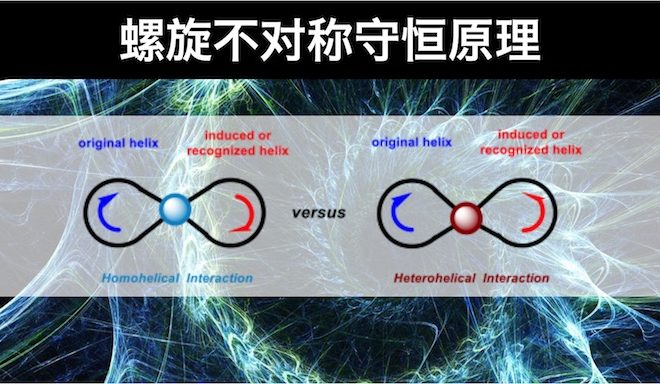
上篇文章里,小编介绍了螺旋不对称守恒原理的基本理论体系,本篇文章小编详细介绍如何进行手性分子螺旋特性的判断。
左手螺旋与右手螺旋的判断方法
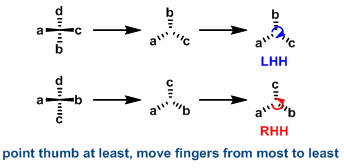
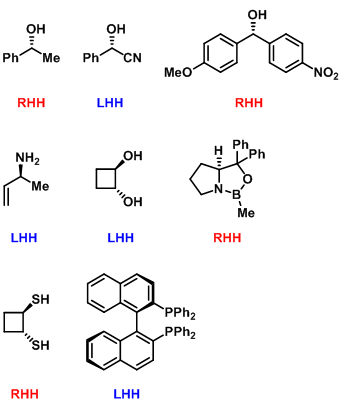
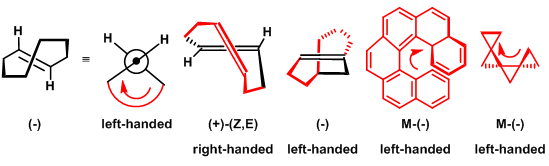
手性分子左手螺旋与右手螺旋的判断方法与手性化合物绝对构型(R与S构型)的判断方法类似。区别在于螺旋特性判断的关键在于正确指认不同原子与基团的极化性(基团极化性是指基团的电子密度在电场中发生变形的敏感程度。随着电子密度、原子核体积与电子壳层的增加、原子核对核外电子吸引力的降低及HOMO-LUMO间能隙的增大而增加)。判断方法如下:将极化性最小的原子或基团置于平面外,再根据基团的极化性由大到小进行旋转,如果旋转方向为顺时针,则该手性分子为右手螺旋(Right-Handed Helicity,RHH);如果旋转方向为逆时针,则该手性分子为左手螺旋(Light-Handed Helicity,LHH)。
不同原子与基团的极化性顺序如下
- (1) Brewster折光指数序列: I > Br > SR > Cl > CN > Ar > C=X(X= N, O) > C(烷基基团) > NR2 > OR (R为烷基) > H > D > F。通过这一序列得出三个可极化性顺序的规则:①芳基与π-基团 > 烷基②同一周期,具有较低核电荷数的原子>具有较高核电荷数的原子③同一族中,具有较多电子层数的原子>具有较低电子层数的原子。应用上述原理,可以得出如下极化性顺序: ① Ar (Ar为芳基与π-基团)> R(R为烷基) > OH > H, D ②C=X > X (X = C, N, O) ③C≡C > R(R为烷基) ④ C≡C > O ⑤ Ph > C=O, C=N ⑥Ph >环丙基; P=O > R ⑦ N=C > C ⑧O=Os > C ⑨ R3P中,P > C ⑩ S > C > N, O,且硼负离子> C.
- (2)过渡金属(Rh, Ru, Pd, Ti, Os) > C(有机基团)及N
- (3)高键级键>低键级键,C≡C > C=C > C-C
- (4) 张力烷基>非张力烷基,例如: 环丙基中的C > Me, i-Pr中的C; 五元环中的CH2 >线性基团CH2CH2tBu中的CH2
- (5) 对于简单烷基而言, 取代基较少的烷基>取代基较多的烷基,例如: CH3 > 1o CH2R > 2o CHR2 > 3o CR3 (因为可极化性C-H > C-C)
- (6) 富电子基团>缺电子基团。例如:芳烃的极化性,富电子芳烃>缺电子芳烃
a. PhOMe > PhR > Ph > PhNO2
b. Ph > 吡啶 > 噻唑 > 噁唑
- (7) 环氧化合物中的O > C(三元环氧化物中,伸出的孤对电子的Opy与Opz轨道中的电子与两个张力的O-Cσ-轨道中的电子,受到原子核的吸引力较弱,因而与烷基相比具有较高的可极化性)
- (8) 孤对电子 > 键对电子。例如:孤对电子> S-O键中的键对电子, Ts基团中的S=O 键或Ph中的C=C键
- (9) 中心碳原子与羰基的局部可极化性受到与其相连的原子的影响或遇到杂化状态相似的基团时,无法用上述方法进行判断,这时需要采用加和方法进行计算.
各类手性分子中的螺旋结构简介
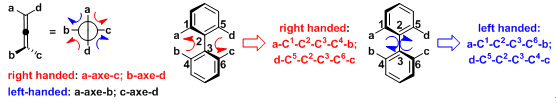
轴手性分子的螺旋结构
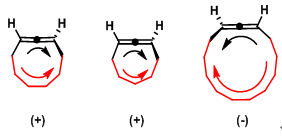
联烯分子的螺旋结构可采用Newman投影式进行观察: 由a轴到c轴 (右手螺旋); b轴到d轴(右手螺旋); a轴到b轴 (左手螺旋) 及c轴到d轴 (左手螺旋)。联芳中存在四种螺旋结构: a-C1-C2-C3-C4-b (右手螺旋); d-C5-C2-C3-C6-c (右手螺旋); a- C1-C2-C3-C6-c (左手螺旋) d- C5-C2-C3-C6-b (左手螺旋)。这些螺旋结构中每一种既是几何螺旋又是物理螺旋。
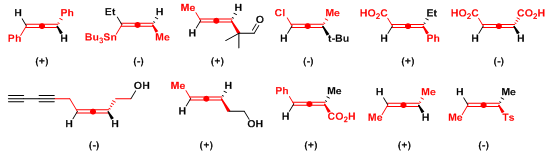
联烯与联芳中存在两种右手螺旋与两种左手螺旋,分子的旋光方向由其总的螺旋特性决定。对于联芳, 这种总的螺旋特性通常难以指认,因为每种螺旋特性对旋光的贡献受到取代基极化特性与阻转异构二面角的控制较为明显。然而, 对于刚性的联烯而言,总的螺旋特性可以十分容易地进行指认,因为螺旋特性对旋光的贡献仅受到取代基极化特性的控制,即总的螺旋特性由分子中极化性最强的两个取代基决定。之前已经提出了联烯绝对立体化学与旋光符号相关的重要经验规则,称为Lowe规则。Lowe规则指出将联烯沿与其最上方纵轴方向具有较大极化性的取代基的正交轴方向进行观察。如果水平轴上的极化性较高的基团位于右侧,则该对映体为右旋,反之亦然。通过 Lowe规则可建立起旋光符号与主要的螺旋手性特性间的关联。一些联烯的螺旋特性如下所示 (主要螺旋结构用红色标记).
违背Lowe规则的一些环状联烯已有文献报道, 联烯骨架的主要的螺旋手性特性与观察到的旋光符号相反。然而,根据螺旋规则同样可以给出合理的解释。下列分子中, 环中较大的几何螺旋(用红色表示) 对分子的旋光符号起主要作用。
平面手性分子中的螺旋结构
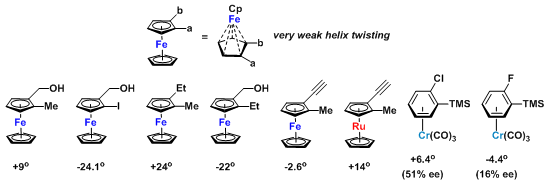
物理螺旋: 典型平面分子的物理螺旋,如邻位取代的光学活性的二茂铁,可通过形式上将η5-键简化为五个单键,将其转化为点手性,而十分容易地进行观察。Cp环的构型使五个碳中心的极化性近乎相同,同时,环中出现强烈的螺旋扭曲。这两个因素使这类分子中出现非常弱的物理螺旋(另一种螺旋,即-a-C-C-b-, 下图未标出,可能由于底面FeCp组分的存在而产生排斥,同时,在a-C与b-C 键的极化性差异较小时,螺旋可能同样比较弱)。因此,当取代基a与b为原子或线性基团时,分子将表现出非常小的旋光度值。
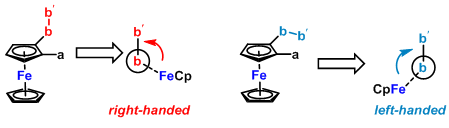
几何螺旋:当取代基a与b不是线性基团时, 分子可能形成有利的构象,因此,形成明显的几何螺旋。这种情况下,分子的旋转可能非常强烈。下图为非线性基团b-b′与CpFe组分间形成的几何螺旋。其几何螺旋可以通过金属茂基团与直接位于Newman投影式上方的b-b′组分的相对取向进行指认。如果金属茂位于观察者右侧,则可以确定分子属于右手螺旋,而且旋光方向为右旋,反之亦然。这是早期Schlögl等提出的光学活性金属茂的绝对构型与旋光符号进行关联的重要理论基础。
其它手性分子中的螺旋结构
下列分子的主要螺旋已用红色标记出:无一例外,分子总体的右手螺旋特性形成的旋光方向为右旋,左手螺旋特性形成的旋光方向为左旋。这种π- 与σ-螺烯长期以来一直视为手性的一种特殊情况。现已认识到螺旋特性为分子手性的最普遍形式。根据这种固有的手性特性,复杂分子的手性可以归结为两种类型: 右手螺旋与左手螺旋。
通过这两篇文章的介绍,相信大家对螺旋不对称守恒原理的概念与基本的理论有了较为深入的了解。下篇文章小编将详细介绍如何应用螺旋不对称守恒原理解释对映选择性反应所得产物的绝对立体化学。
参考文献
- J. H.Brewster, Top. Steroechem. 1967, 2, 1. doi: 10.1002/9780470147115.ch1.
- J., Miller, J. Am.Chem. Soc, 1990, 112, 8533. doi: 10.1021/ja00179a044.
- 3. G. Lowe, Chem. Comm. 1965, 411. doi: 1039/C19650000411.
- G. Krow, Top. Stereochem. 1970, 5, 31. doi: 10.1002/9780470147146.ch2.
- W. R. Moore, H. W. Anderson, S. D. Clark, T. M. Ozretich, J. Am. Chem. Soc. 1971, 4932. doi: 10.1021/ja00748a059.
- K. Schlögl, H.Falk, Tetrahedron, 1966, 22, 3047. doi: 10.1016/S0040-4020(01)82284-5.
- A. Cope, C. F. Howell, A. Knowles, J. Am. Chem. Soc. 1962, 84, 3190. doi: 10.1021/ja00875a035.
- S. I. Kozhushkov, P. R. Schreiner, A. Wittkopp, D. S. Yufit, Angew. Chem. Int. Ed. 1999, 38, 3474. doi:10.1002/(SICI)1521-3773(19991203)38:23<3474::AID-ANIE3474>3.0.CO;2-6.
- R. S. Cahn, C. Ingold, V. Prelog, Angew. Chem. Int. Ed. 1966, 5, 385. doi: 10.1002/anie.196603851.
- J. H. Brewster, J. Am. Chem. Soc. 1959, 81, 5483. doi:10.1021/ja01529a057.
- J. H. Brewster, J. Am. Chem. Soc. 1959, 81, 5475. doi:10.1021/ja01529a056.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!























No comments yet.