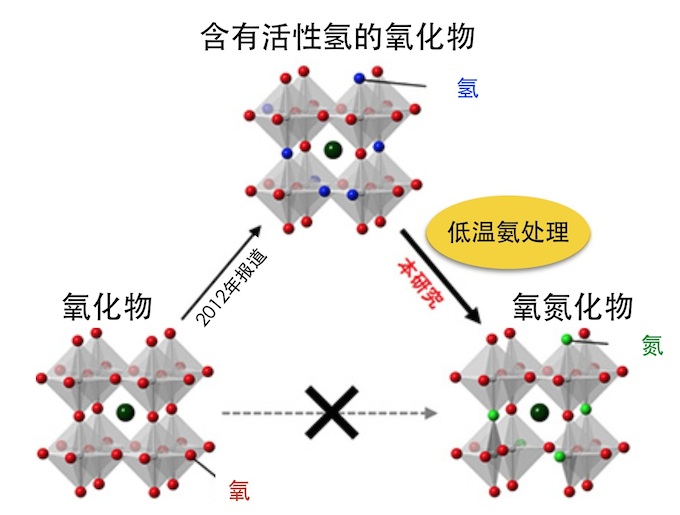
本文作者:杉杉
导读
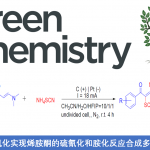
近日,瑞士洛桑联邦理工学院祝介平教授课题组在Angew. Chem. Int. Ed.上发表论文,报道了在温和的光氧化还原催化条件下,实现了共轭二烯、N-氨基吡啶鎓盐和TMSNCS的三组分反应,以高度化学和区域选择性的方式合成1,2-氨基异硫氰基化产物(aminoisothiocyanation)。机理研究表明,在光催化条件下,烯丙基硫氰基化物易异构化为烯丙基异硫氰基化物是产物选择性的主要原因。
Selective 1,2-Aminoisothiocyanation of 1,3-Dienes Under Visible Light Photoredox Catalysis
Weisi Guo, Qian Wang, and Jieping Zhu
Angew. Chem. Int. Ed. ASAP DOI:10.1002/anie.202014518 https://doi.org/10.1002/anie.202014518
正文
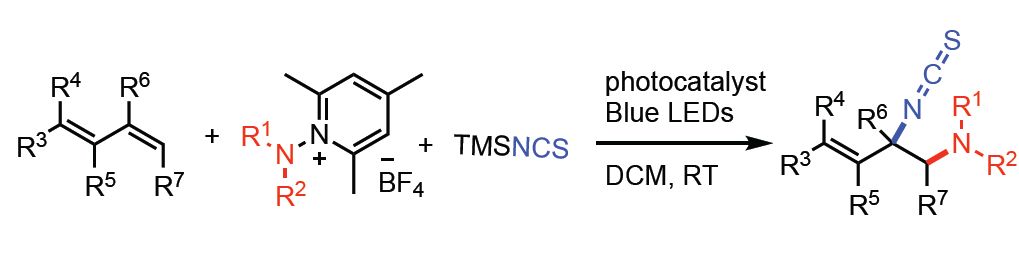
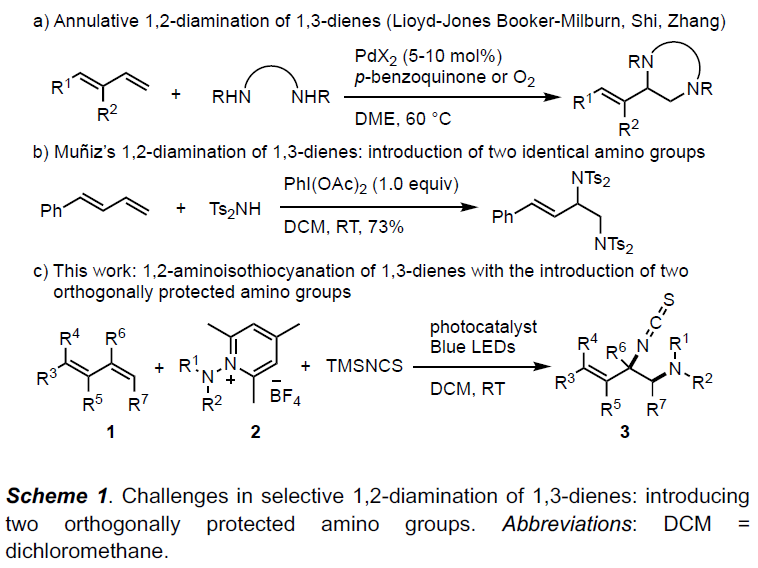
1,3-二烯的选择性官能团化,作为合成具有价值化合物的有效方法,但也存在一定的挑战性。同时,含氮化合物普遍存在生物活性天然产物和药物中。因此,将氨基或其它官能团同时引入1,3-二烯的双官能化反应,已引起广泛的关注。目前,已报道简单烯烃的双胺化[1-2]、硫胺化[3]、氧胺化[4]、氟胺化[5]、氨甲基氨基化[6]和氨基烷基化/芳基化[7-8]等反应。然而,对于共轭烯烃同时选择性引入两个保护氨基仍具有挑战性。为了避免区域选择性问题,这些试剂的两个氨基必须具有相同的保护基(Scheme 1a)。Muñiz课题组[9]报道了Ts2NH与1,3-二烯进行1,2-二胺化反应的唯一例子(Scheme 1b)。此外,异硫氰酸盐(NCS)和硫氰酸盐(SCN)作为天然产物和生物活性化合物中常见的官能团,同时也是构建含氮和硫衍生物的重要组成部分。虽然已报道关于烯烃的选择性硫氰化反应[10-14],但对于1,3-二烯的氨基异硫氰化反应却从未被报道。在此,瑞士洛桑联邦理工学院祝介平教授课题组报道,在温和的可见光光氧化还原催化条件下,实现共轭二烯1、N-氨基吡啶鎓盐2与TMSNCS的三组分1,2-氨基异硫氰化反应,获得良好收率以及优异化学和区域选择性的目标1,2-氨基异硫氰基产物3(Scheme 1c)。
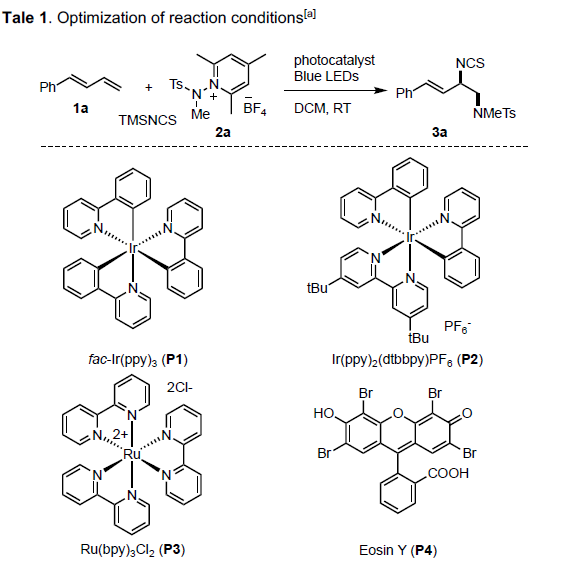
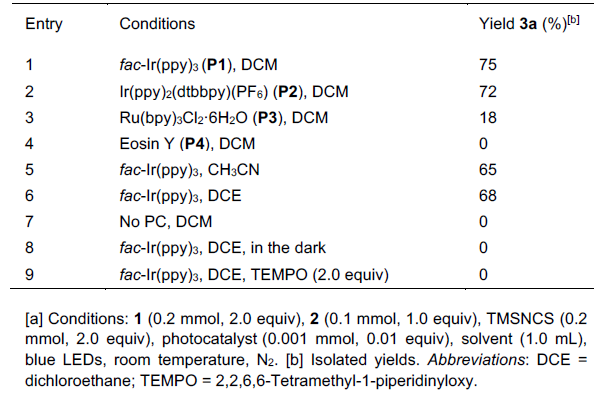
首先,作者以(E)-1-苯基-1,3-丁二烯(1a)、N-氨基吡啶鎓盐2a和TMSNCS作为模型底物,进行了相关反应条件的筛选(Table 1)。最佳条件:以fac-Ir(ppy)3作为光敏剂,在室温蓝色LED照射于DCM反应,即可获得75%收率的目标产物3a。
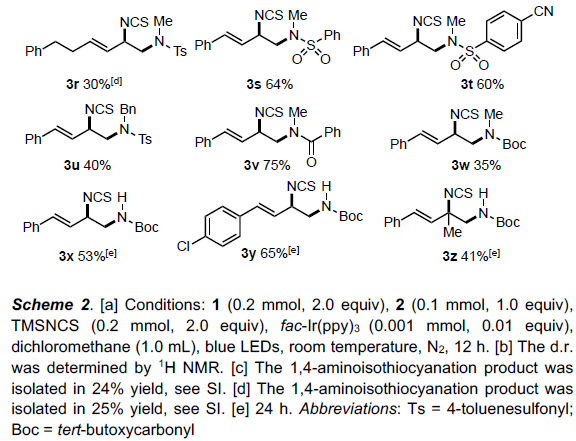
在获得上述最佳反应条件后,作者开始对底物1和2进行了扩展(Scheme 2)。在对二烯底物1扩展时发现,1-芳基-1,3-丁二烯的苯环不受电子效应影响,均可获得相应的产物3a-3j。同样,萘(3k)和苯并呋喃(3l)也与反应条件兼容。1,1-,1,2-和1,3-二取代的1,3-二烯参与反应,以良好的产率提供相应的产物3m-3o。1-苯基-1,3-戊二烯的反应显示出较高的化学选择性和区域选择性,以两种非对映异构体的混合物形式得到产物3p(d.r. = 3:2)。烷基取代的二烯(3q和3r)也取得了较好的结果。其次,在对吡啶鎓盐底物2扩展时发现,各种N-氨基吡啶鎓盐衍生物(RSO2N•R1,RCON•R1,tBuOCON•R1)均可进行反应,获得相应的产物3s-3z。值得注意的是,当使用E/Z二烯的混合物作为起始原料时,仅分离出了E-烯烃。同时,克级实验获得相似的3a收率(1.05g,76%)。
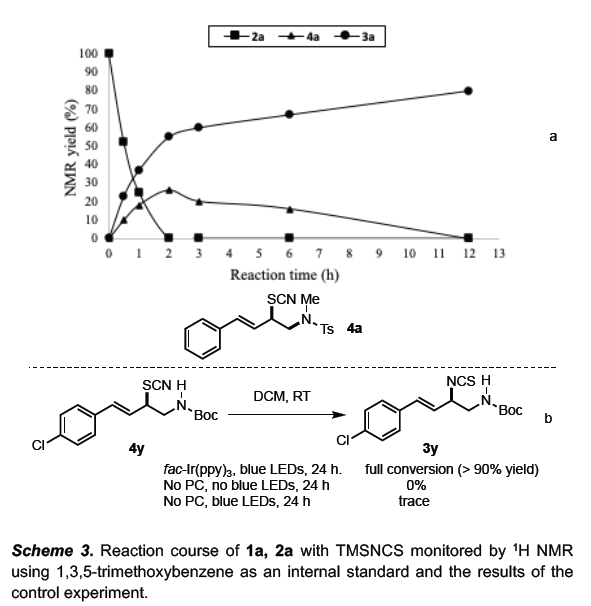
随后,为了进一步了解异硫氰级官能团的化学选择性,作者对1a、2a和TMSNCS之间的反应进程进行了1H NMR跟踪(Scheme 3a)。结果表明,初始阶段,同时形成了产物3a和4a。反应2小时后,N-氨基吡啶鎓盐2a被消耗完,继续反应后4a逐渐转化为3a。为了进一步证实此结果,作者分离了纯的氨基硫氰化产物4y,并在fac-Ir(ppy)3催化条件下,获得产物3y。同时,对照实验表明,光氧化还原催化剂和蓝色LED的照射对于这种异构化都是必不可少的(Scheme 3b)。
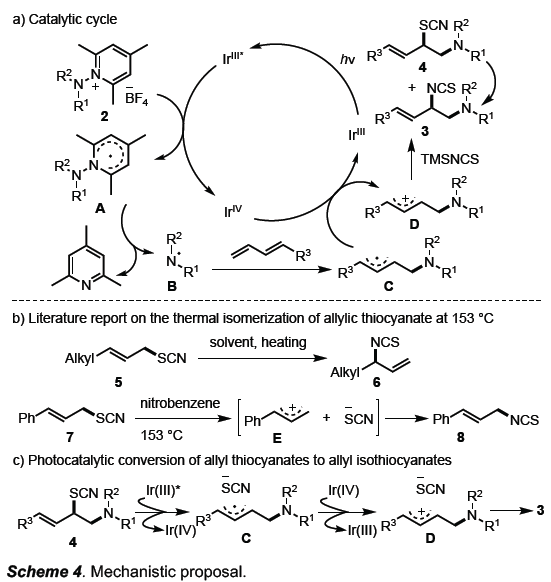
根据上述的实验,作者提出了一种可能的反应机理(Scheme 4a)。首先,激发态的IrIII*物种还原N-氨基吡啶鎓盐2,形成自由基A,经裂解后得到氮中心自由基B和2,4,6-三甲吡啶。紧接着,自由基B与1,3-二烯的区域选择性加成生成烯丙基自由基C。随后,IrIV氧化自由基C形成碳正离子中间体D,同时产生Ir(III)配合物。最后,TMSNCS与烯丙基阳离子E经高区域选择性亲核加成,从而获得1,2-氨基异硫氰化和1,2-氨基硫氰化产物3和4的混合物。但是,随着反应时间的延长,4会转化为3。此外,据文献报道[15],3-烷基取代的底物5在苛刻的条件下(153 ℃)经σ重排形成异构体的异硫氰酸酯6,而硫氰酸肉桂基7则没有发生1,3-移位,从而表明反应经一系列的电离过程,形成烯丙基阳离子E和硫氰酸盐,然后进行区域选择性重组(Scheme 4b)。同时,作者认为激发态的IrIII*能将烯丙基硫氰化物4还原为烯丙基自由基C和硫氰酸根离子。Ir(IV)将C氧化为烯丙基阳离子D,然后进行区域和化学选择性亲核捕获,从而得到主产物3(Scheme 4c)。
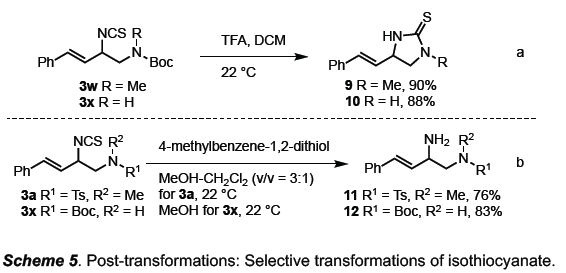
最后,为了进一步证明反应的实用性,作者对产物进行了衍生化(Scheme 5)。3w和3x经N-脱保护和分子内环化,从而获2-咪唑烷硫酮9和10。此外,在室温下,3a和3x与4-甲基苯-1,2-二硫醇反应,则获得选择性保护的1,2-二胺产物11和12。
总结
瑞士洛桑联邦理工学院祝介平教授课题组报道了一种新型的三组分反应(即氨基吡啶鎓盐、1,3-二烯和TMSNCS),以高度化学和区域选择性的方式合成1,2-氨基异硫氰基产物(可进一步转化1,2-二胺产物)。值得注意的是,该反应是通过1,3-二烯选择性合成1,2-二胺化的第一个例子。
参考文献:
[1] Selected examples of 1,2-diamination: a) G. L. J. Bar, G. C. Lloyd-Jones, K. I. Booker-Milburn, J. Am. Chem. Soc. 2005, 127, 7308; b) H. Du, B. Zhao, Y. Shi, J. Am. Chem. Soc. 2007, 129, 762; c) B. Zhao, X. Peng, S. Cui, Y. Shi, J. Am. Chem. Soc. 2010, 132, 11009; d) A. Lishchynskyi, K. Muñiz, Chem. Eur. J. 2012, 18, 2212; e) Z. Wu, K. Wen, J. Zhang, W. Zhang, Org. Lett. 2017, 19, 2813.
[2] 1,4-Diamination, see: a) B. Akermark, J.-E. Bäckvall, K. Löwenborg, K. Zetterberg, J. Organomet. Chem. 1979, 166, C33; b) C. Martínez, L. Martínez, J. Kirsch, E. C. Escudero-Adán, E. Martin, K. Muñiz, Eur. J. Org. Chem. 2014, 2017.
[3] C. E. Sleet, U. K. Tambar, Angew. Chem. Int. Ed. 2017, 56, 5536. Angew. Chem. 2017, 129, 5628.
[4] 1,2-Selective, see: a) D. J. Michaelis, M. A. Ischay, T. P. Yoon, J. Am. Chem. Soc. 2008, 130, 6610; b) H.-C. Shen, Y.-F. Wu, Y. Zhang, L.-F. Fan, Z.-Y. Han, L.-Z. Gong, Angew. Chem. Int. Ed. 2018, 57, 2372; Angew. Chem. 2018, 130, 2396; c) K. Wen, Z. Wu, B. Huang, Z. Ling, I. D. Gridnev, W. Zhang, Org. Lett. 2018, 20, 1608; d) K. Wen, Z. Wu, B. Chen, J. Chen, W. Zhang, Org. Biomol. Chem. 2018, 16, 5618; e) B. N. Hemric, A. W. Chen, Q. Wang, ACS Catal. 2019, 9, 10070.
[5] D.-F. Lu, C.-L. Zhu, J. D. Sears, H. Xu, J. Am. Chem. Soc. 2016, 138,11360.
[6] Y. Liu, Y. Xie, H. Wang, H. Huang, J. Am. Chem. Soc. 2016, 138, 4314.
[7] 1,4-Aminoalkylation/arylation, see: a) H. Bao, L. Bayeh, U. K. Tambar, Chem. Sci. 2014, 5, 4863; b) H.-M. Huang, M. Koy, E. Serrano, P. M. Pflüger, J. L. Schwarz, F. Glorius, Nat. Catal. 2020, 3, 393.
[8] a) D. Xing, D. Yang, Org. Lett. 2013, 15, 4370; b) K. P. S. Cheung, D. Kurandina, T. Yata, V. Gevorgyan, J. Am. Chem. Soc. 2020, 142, 9932.
[9]A.Lishchynskyi, K. Mu±iz, Chem. Eur. J. 2012, 18, 2212.
[10] a) A. De Mico, R. Margarita, A. Mariani, G. Piancatelli, Tetrahedron Lett. 1996, 37, 1889; b) M. Bruno, R. Margarita, L. Parlanti, G. Piancatelli, M. Trifoni, Tetrahedron Lett. 1998, 39, 3847; c) V. Nair, L. G. Nair, Tetrahedron Lett. 1998, 39, 4585.
[11] Z. Liang, F. Wang, P. Chen, G. Liu, Org. Lett. 2015, 17, 2438.
[12] D. Zhang, H. Wang, C. Bolm, Chem. Commun. 2018, 54, 5772.
[13] Z.-K. Tao, C.-K. Li, P.-Z. Zhang, A. Shoberu, J.-P. Zou, W. Zhang, J. Org. Chem. 2018, 83, 2418.
[14] H. Tian, J. Yu, H. Yang, C. Zhu, H. Fu, Adv. Synth. Catal. 2016, 358, 1794.
[15] a) P. A. S. Smith, D. W. Emerson, J. Am. Chem. Soc. 1960, 82, 3076; b) J. Gonda, M. Martinková, J. Imrich, Tetrahedron 2002, 58, 1611.





















No comments yet.