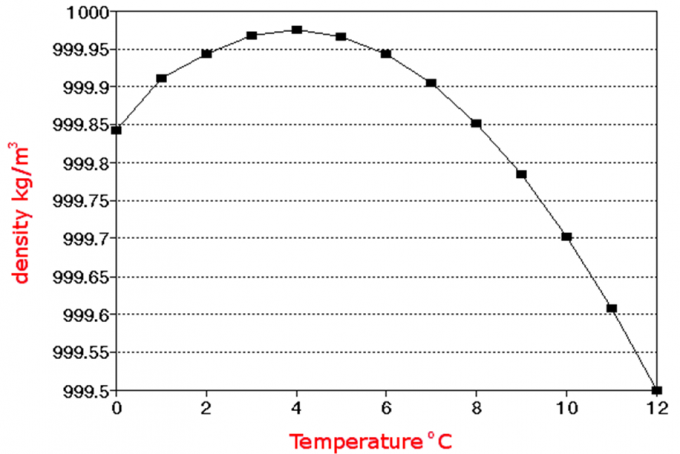
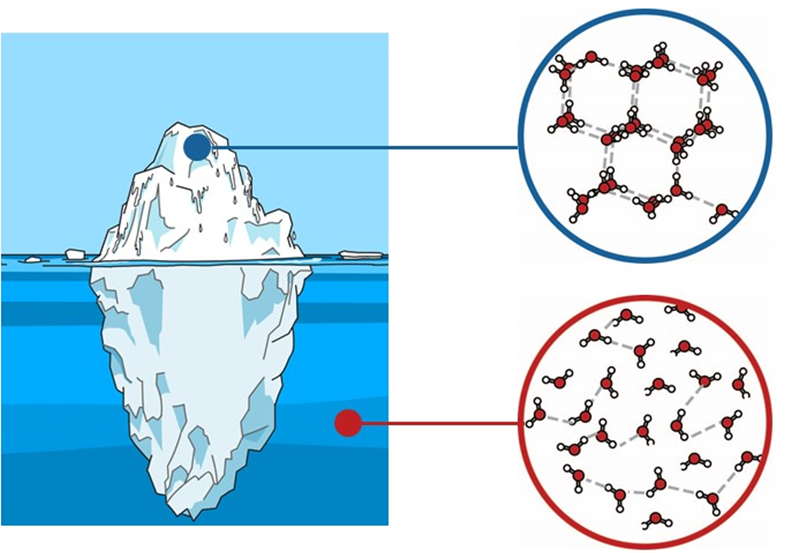
对一般物质而言,其密度具有以下规律:固体>液体>气体。而水并不是这样。水的密度比冰大,浮冰就是很好的例子。图片来源:pixabay.com
事实上,水在4℃时密度最大。
图片来源:
http://labman.phys.utk.edu/phys221core/modules/m9/phases_of_water.html
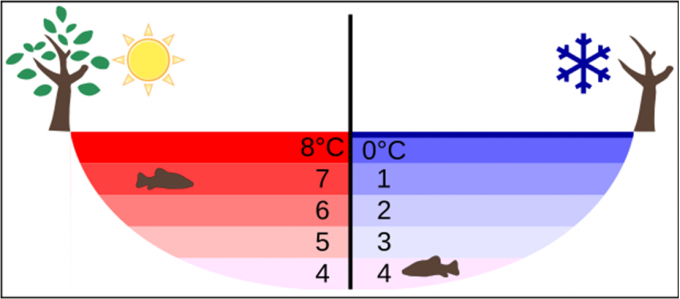
在冬天,就结冰的湖水来说,上表面温度为0℃,往下依次增加,最下层是4℃。夏天却刚好相反。水的这一独特性质,保证了结冰的湖水中仍然存在着液态水,这对于水中生物至关重要。而陆地生物又源自海洋,所以水的这一性质对于地球上的生命来说是至关重要的。
图片来源:
https://courses.lumenlearning.com/introchem/chapter/volume-and-density/
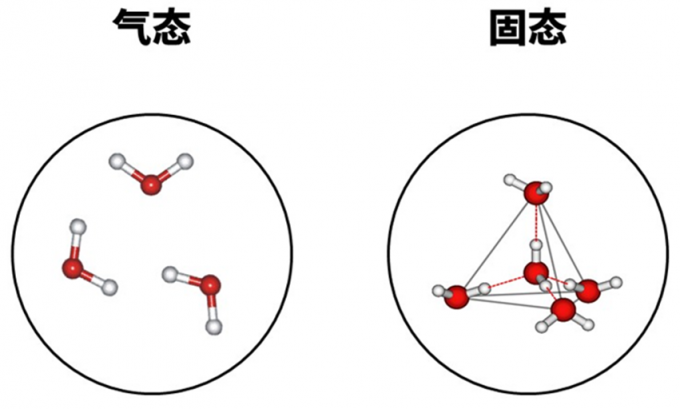
那么,这一独特的性质是如何产生的呢?我们从相对简单的入手,先讨论气态和固态水。气态水就是水分子杂乱无章的分布。对于固态水来说,由于氢键的原因,水分子形成这种稳定的四面体结构。
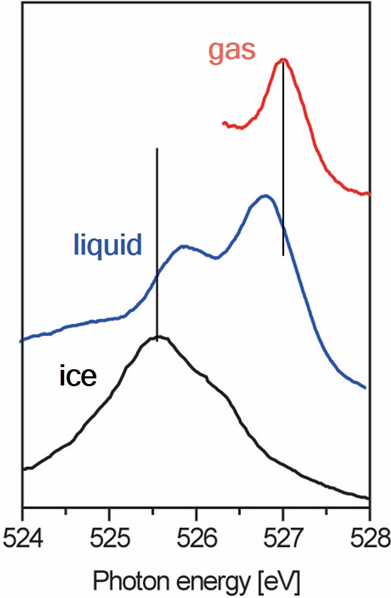
气态、液态、固态三者的X射线光谱如下:
图片来源:
https://www.youtube.com/watch?v=7hGqlEpvODw&t=820s
液态水明显含有两个峰,两个峰分别和气态、固态接近。这说明,液态水中含有两种结构,这两种结构分别和其气态和固态时相似。
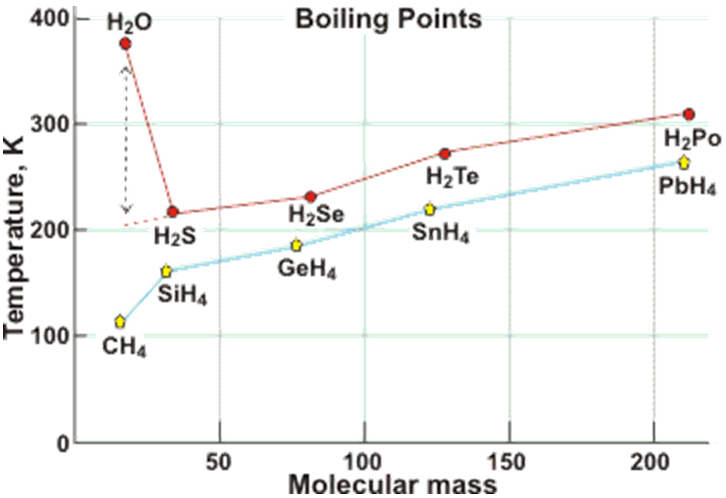
氢键对于水至关重要。举个简单的例子,对于C族元素来说,在元素周期表上,从上到下的氢化物,其沸点逐渐增加。原因倒也简单,从上到下,分子质量增加,分子间范德华力增加。按理说,氧族也应该符合这一规律。但是,实际情况是,水个性十足,不按常理出牌。就是因为水中含有氢键,氢键的强度大于范德华力,所以水分子间作用力比同族其他氢化物要强,沸点自然就高了。
图片来源:
http://www1.lsbu.ac.uk/water/phase_anomalies.html
液态水中为何同时存在两种情况呢?这就要引入另一个概念,熵,可理解为混乱程度。水分子骨子里是向往自由的,所以存在类似气态的结构。由于氢键的存在,部分水分子又被限制到类似正四面体的结构中。只有当温度低到一定程度(凝固点,0℃),水分子运动被较大程度的限制,这时氢键占据主导作用,就成为规整的正四面体结构。
回到那个问题:冰浮于水,为什么呢?
这是因为,固态水中水分子是规整的四面体结构,其空隙较大。液态水中的水分子是相对混乱的,反而比较致密一些。固态水的密度小于液态水,所以冰浮于水也就可以理解了。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!





















No comments yet.