本文作者:石油醚
导读
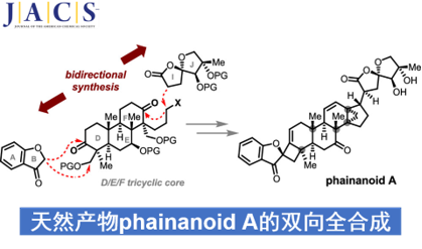
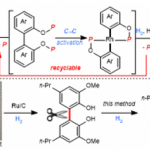
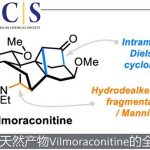
近日,Chicago大学的董广彬团队报道一种通过双向合成策略 (bidirectional synthetic strategy)进行的DTT (dammarane-type triterpenoid) 类天然产物phainanoid A的首次全合成。其中,该小组采用双重过渡金属试剂促进的高度非对映选择性合成转化过程,进而顺利完成phainanoid A分子中核心三环骨架两端的张力环体系的构建。本文全合成路线设计的关键步骤中涉及酮或烯醇三氟甲磺酸酯砌块的策略性应用。
Bidirectional Total Synthesis of Phainanoid A via Strategic Use of Ketones
J. Xie, X. Liu, N. Zhang, S. Choi, G. Dong, J. Am. Chem. Soc. 2021, ASAP. Doi:10.1021/jacs.1c11117.
正文:
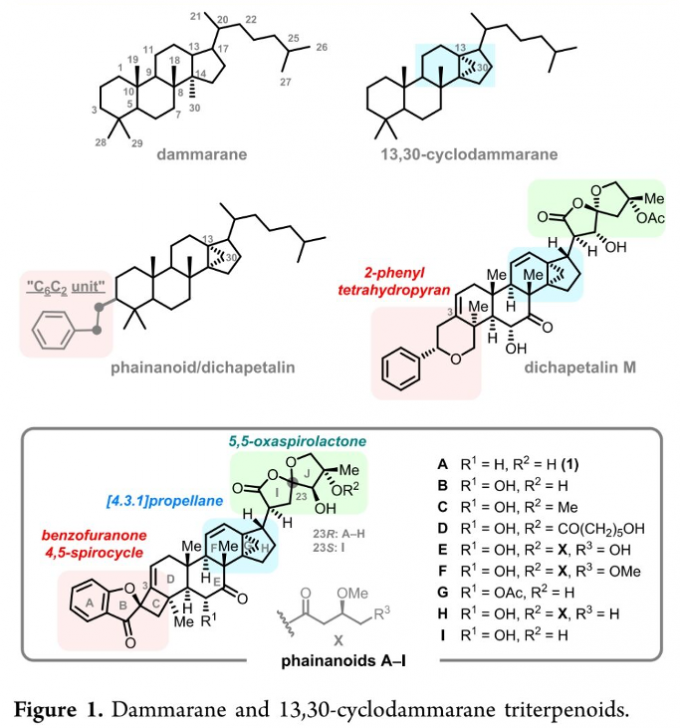
近期,在C3位置具有C6C2结构单元的新型CDTT (13,30-cyclodammarane-type triterpenoid) 类天然产物phainanoid由植物Phyllanthus hainanensis Merr.中成功分离。phainanoid类天然产物分子的环骨架中具有独特的[4.3.1]螺桨烷结构单元,同时,侧链中具有5,5-oxaspirolactone 单元 (Figure 1)。上述的结构特征与dichapetalin类天然产物具有高度的相似性,并表现出高度的生物活性。然而,phainanoid类天然产物全合成策略的相关研究,至今尚未有相关的文献报道[1]。这里,Chicago大学的董广彬团队报道首例DTT (dammarane-type triterpenoid) 类天然产物phainanoid A的全合成。
phainoids类天然产物全合成中面临的挑战在于:首先,分子中同时具有高度环张力的4,5-螺环 (A/B/C环)与[4. 3. 1]螺桨烷 (F/G/H环)骨架,实现上述结构的立体选择性构建,将面临诸多的困难。同时,在目前已知的phainoids类分子中,至少存在八个完全取代的手性中心,其中有五个手性中心属于全碳的四级手性中心,尤其在较为拥挤的C8−C14−C13位置,进行连续四级碳手性中心的构建,将面临前所未有的挑战。并且,对于分子中具有较高反应活性的5,5-oxaspirolactone 骨架单元 (I/J 环)的构建,同样将面临极大的挑战。
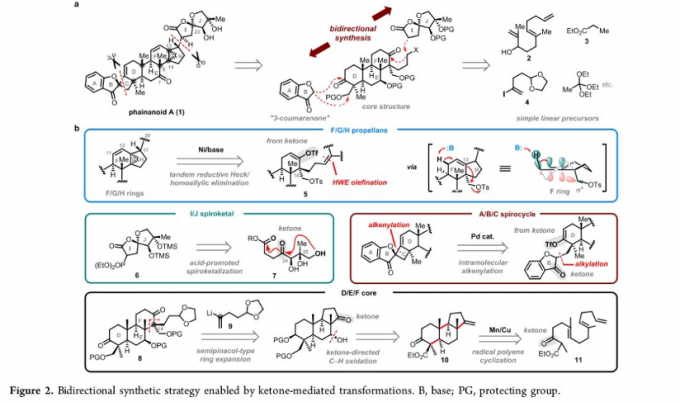
这里,作者设想,采用全新的双向合成路线,能够有效地完成phainanoid A分子的全合成 (Figure 2)。其中,关键步骤主要涉及:(i) 通过tandem Ni催化的串联的还原Heck反应[2]/高烯丙位消除反应[3],进行分子中[4.3.1]螺桨烷结构单元的构建 (ii)通过酸催化的螺缩酮化反应,构建I/J螺环,并通过HWE反应,与phainanoid A分子中的核心骨架进行连接 (iii) A/B/C苯并4,5-螺环片段则通过Pd催化的非对映选择性烯醇三氟甲磺酸酯片段与3-香豆冉酮 (3-coumaranone)片段之间的分子内烯基化[1]反应进行构建 (iv) 通过Mn(III)试剂促进的立体选择性多烯环化[4]反应、酮导向的C-H氧化[5]以及由五元环向六元环的环扩张[6]步骤,进而完成D/E/F三重稠环片段的构建。
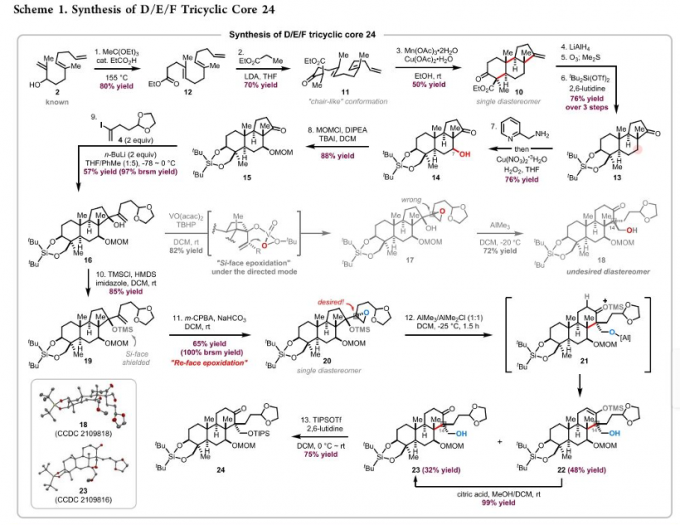
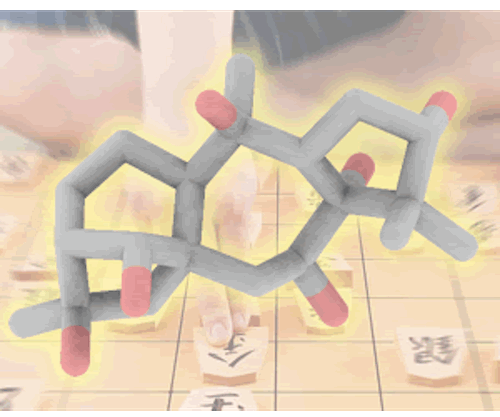
首先,作者进行phainanoid A分子中三环核心骨架 (D/E/F)的构建 (Scheme 1)。该小组采用烯丙醇2作为起始原料,依次经历Johnson-Claisen 重排、与丙酸乙酯之间的Claisen 缩合,获得相应的 β-酮酯 11。再通过Mn(OAc)3 与Cu(OAc)2促进的砌块11的自由基多烯环化过程,立体选择性地获得相应的三环砌块 10,并经历后续的羰基还原、臭氧解以及二醇保护的三步官能团变换,形成酮砌块13,并通过Baran改进的Schönecker C-H氧化反应方法学[7],在酮砌块13的C7位置中引入羟基,获得相应的醇砌块 14,之后通过引入MOM保护基团,并进一步采用立体选择性的乙烯基锂加成,获得砌块 16。砌块 16中的三级醇结构片段通过TMS基团进行保护之后,再通过m-CPBA参与的立体选择性环氧化以及混合Lewis酸 (AlMe3/AlMe2Cl) 促进的半频哪醇重排过程,进而获得具有预期C-14立体构型的三环砌块 23。接下来,将23中的一级醇片段通过TIPS基团保护,获得双向合成策略中的关键中间体 24。
考虑到螺环缩酮结构片段具有高度的反应活性,接下来,作者开始进行A/B/C/D/E/F六环骨架的构建(Scheme 2)。通过中间体24中硅基化的1,3-二醇保护基团的选择性去除、一级醇片段的选择性氧化以及TES保护基团的引入,形成砌块 25。通过砌块 25与芳基锂试剂 26之间的羰基加成/硅基转移/β-消除的串联反应过程,形成相应的缩合产物 27,27经历TES保护基团的去除与Dess-Martin氧化,获得二酮砌块 28。由于TIPS基团对于F环中酮羰基的屏蔽作用,因而能够有效地完成D环中酮羰基的化学选择性三氟甲磺酸化,形成砌块 29,再通过Pd/C对于29中烯酮片段的氢化过程,获得中间体30。并进一步通过Pd-QPhos-G3催化的分子内烯基化过程,完成phainanoid A分子中关键的4,5-螺环 (A/B/C)骨架砌块31的构建。最后,作者进行phainanoid A分子中G/H/I/J环骨架的构建 (Scheme 2)。作者进一步将砌块 31依次通过去除TIPs保护基团,引入Ts基团,获得相应的磺酸酯砌块32,并在酸性条件下同时去除1,3-dioxolane与MOM保护基团,形成半缩醛砌块33。之后再与5,5-氧杂螺内酯衍生的膦酸酯6通过HWE反应,获得等量的产物34a与34b,34b进一步通过LiBr[8]与Ni(cod)2条件下的串联还原 Heck 环化/高烯丙基消除反应,完成G/H双环砌块38的构建,38经历后续的C7醇片段氧化以及TMS保护基团的去除,最终完成天然产物(±)-phainanoid A的全合成。
总结
董广彬教授团队通过双向合成的策略设计,成功实现天然产物phainanoid A的首次全合成。这一全合成路线中的关键步骤主要涉及自由基多烯环化、导向型C-H氧化、基于羰基结构的扩环反应、酸催化的螺缩酮化等。
参考文献
[1] J. Xie, J. Wang, G. Dong, Org. Lett. 2017, 19, 3017. doi: 10.1021/acs.orglett.7b01303. [2] T. Ghosh, Chemistry Select. 2019, 4, 4747. doi: 10.1002/slct.201804029. [3] J. Tadanier, J. Org. Chem. 1966, 31, 2124. doi: 10.1021/jo01345a017. [4] B. B. Snider, Chem. Rev. 1996, 96, 339. doi: 10.1021/cr950026m. [5] B. Schönecker, T. Zheldakova, Y. Liu, M. Kötteritzsch, W. Günther, H. Görls, Angew. Chem. Int. Ed. 2003, 42, 3240. doi: 10.1002/anie.200250815. [6] Z. Song, C. Fan, Y. Tu, Chem. Rev. 2011, 111, 7523. doi: 10.1021/cr200055g. [7] R. Trammell, Y. Y. See, A. T. Herrmann, N. Xie, D. E. Díaz, M. A. Siegler, P. S. Baran, I. Garcia-Bosch, J. Org. Chem. 2017, 82, 7887. doi: 10.1021/acs.joc.7b01069. [8] J. L. Hofstra, K. E. Poremba, A. M. Shimozono, S. E. Reisman, Angew. Chem. Int. Ed. 2019, 58, 14901. doi: 10.1002/anie.201906815.本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载















No comments yet.