本次介绍的论文报道了使用上游原料硝基芳烃和芳基硼酸进行仲胺合成的方法。本次反应中使用了空气下稳定的钼催化剂,并且底物适用范围非常广。
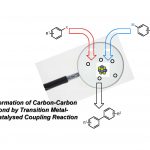
使用硝基的C–N键形成
芳香胺化合物在功能材料和医药及农业化合物中有着很广泛的应用,因此其高效经济的合成方法的开发也成为了有机合成化学领域的一个重要课题。迄今为止,经常使用例如还原胺化和Buchwald-Hartwig偶联反应来进行芳香胺的合成。此外,也报道了一些从亚硝基化合物或羟胺开始的胺化反应。但是,由于这些反应中使用的原料都可以通过还原硝基芳烃来获得,因此直接使用硝基化合物作为原料可以减少步骤数。使用芳族硝基化合物的胺化反应的已知实例包括Cadogan环化反应和Bartoli吲哚合成。近年来,通过在反应体系中巧妙地将硝基化合物还原为亚硝基化合物,从而开发出了使用硝基芳烃作为原料的分子间胺化反应。例如,Baran等人开发了铁催化的硝基芳烃的自由基烷基化反应(图1A)[1a]。此外,还报道了通过有机镁试剂和B2pin2进行的部分还原芳族胺合成法。然而,由于在这些方法中使用的有机金属试剂如镁和锌具有高反应性,因此在官能团兼容性方面仍存在问题[1b,c]。另一方面,Radosevich等人最近报道了使用原创的膦(III)作为催化剂,实现了硝基芳烃与有机硼酸的胺化反应(图1B)[2]。
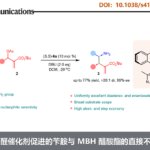
在这里,小编要介绍一篇Sanz等人使用硝基化合物和有机硼酸作为底物,通过使用在空气中稳定的二氧代钼(VI)催化剂和三苯基膦作为还原剂进行的仲胺合成的反应(图1C)。本反应可以在空气下进行是其一大特点。
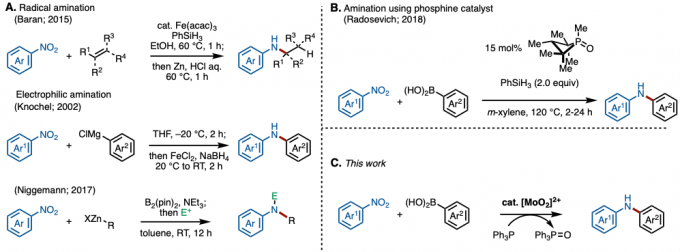
图1.(A)硝基化合物的胺化反应 (B) 硝基化合物的膦催化胺化(C) 本论文的胺化反应
“Reductive Molybdenium-Catalyzed Direct Amination of Boronic Acids with Nitro Compounds”
Suárez-Pantiga, S.; Hernández-Ruiz, R.; Virumbrales, C.; Pedrosa, M. R.; Sanz, R. Angew. Chem., Int. Ed. 2019,58, 2129.
论文作者介绍

履历:
1992-1997 Ph.D., University of Oviedo (Prof. J. Barluenga and Prof. F. J. Fañanás)
1997-2003 Assistant Professor, University of Burgos
2003-2010 Associate Professor, University of Burgos
2010- Full Professor, University of Burgos
研究内容:过渡金属催化剂・有机催化剂催化的新反应开发
论文概要
本反应、使用(MoO2Cl2(dmf)2/bpy为催化剂与三苯基膦作为还原剂,以硝基化合物与有机硼酸为底物进行了芳香胺的合成(图2A)。底物硝基芳烃与芳基硼酸的应用范围很广,无论芳环上的电子或空间因素如何,都能以良好的收率得到所需的仲胺。此外,还可以通过使用杂芳环或多环芳烃获得目标仲胺。
对于该反应的反应机理作者推测如下(图2B)。钼(VI)络合物I被三苯基膦还原后、硝基化合物与钼(IV)配合物配位成II。然后,II被配位的硝基化合物氧化,形成与亚硝基化合物配位的钼(VI)配合物III。从这里开始有两条路径。作为路线A,在钼(VI)配合物III再次被三苯基膦还原后,由于被配位的亚硝基化合物再氧化,形成h2–亚硝基配合物IV。然后,氮原子亲核进攻硼酸,形成氮宾中间体V、硼原子上的R2基发生1,2-重排得到胺基硼酸VI。另一方面、路线B的话,从III解离的亚硝基化合物VII被三苯基膦还原,形成膦盐VIII。然后VIII与硼酸形成氮宾中间体IX、继而与路线A一样发生1,2-重排产生胺基硼酸VI。最后VI发生水解产生目标产物仲胺。
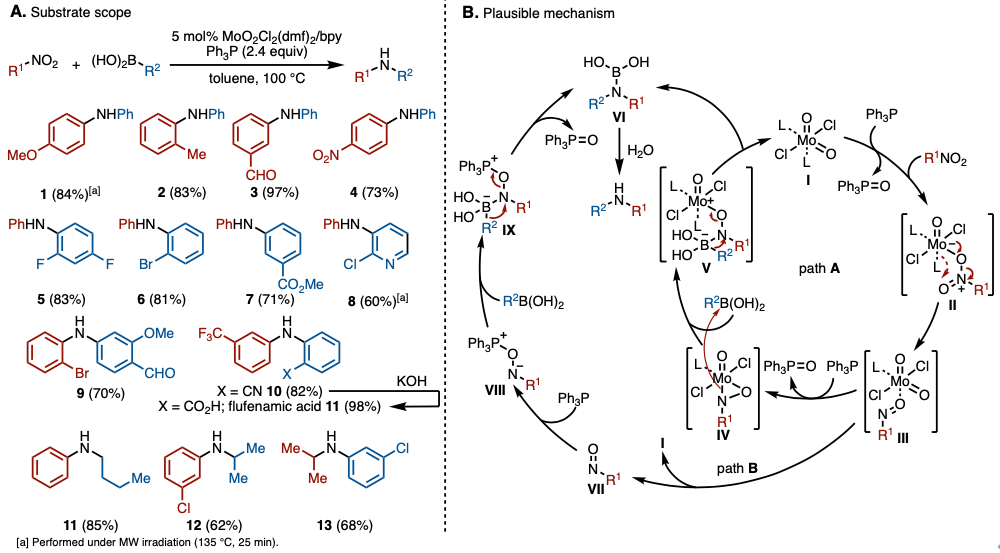
图2. (A) 底物适用范围 (B) 推定反应机理
综上所述、通过使用空气下稳定的钼催化剂I与三苯基膦作为还原剂、实现了硝基化合物与硼酸为原料生成仲胺的反应。本反应底物适用性广,操作简便,期待今后有很广泛的应用。
参考文献
- (a) Gui, J.; Pan, C.-M.; Jin, Y.; Qin, T.; Lo, J. C.; Lee, B. J.; Spergel, S. H.; Mertzman, M. E.; Pitts, W. J.; La Cruz, B. J.; Schmidt, M. A.; Darvatkar, N.; Natarajan, S. R.; Baran, P. S. Science 2015, 348, 886. DOI:1126/science.aab0245(b) Sapountzis, I.; Kochel, P. J. Am. Chem Soc. 2002, 124, 9390. DOI: 10.1021/ja026718r(c) Rauser, M.; Ascheberg, C.; Niggemann, M. Angew. Chem., Int. Ed. 2017, 56, 11570. DOI: 10.1002/anie.201705356
- Nykaza, T. V.; Cooper, J. C.; Li, G.; Mahieu, N.; Ramirez, A.; Luzung, M. R.; Radosevich, A. T. Am. Chem. Soc. 2018, 140, 15200. DOI: 10.1021/jacs.8b10769
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!
















No comments yet.