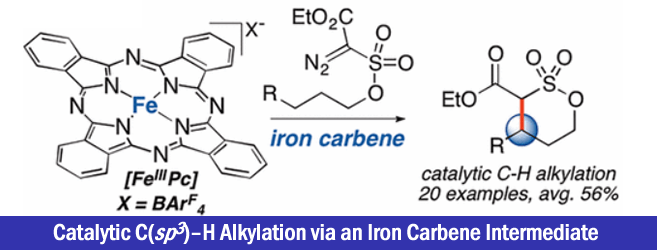
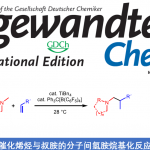
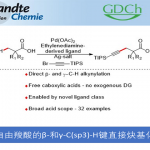
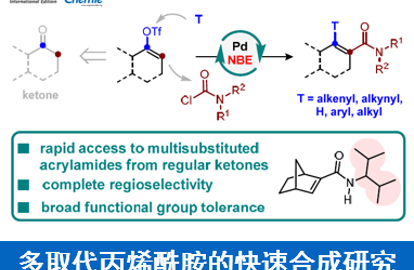
2017年、伊利诺伊大学的 M. Christina White课题组は利用铁酞菁催化剂产生的金属卡宾中间体,实现了烯丙基位/苄基位的C – H烷基化反应。
“Catalytic C(sp3)-H Alkylation via an Iron Carbene Intermediate”
Griffin, J. R.; Wendell, C. I.; Garwin, J. A.; White, M. C.* J. Am. Chem. Soc.2017, 139, 13624-13627. DOI: 10.1021/jacs.7b07602
与以往的研究相比的优异性
到目前为止,虽然有很多后期过渡金属形成卡宾后进行C-H烷基化的报道,然而,通过铁催化生成铁卡宾后进行的反应,仅仅只报道了环丙烷化的应用。2002年报道了铁卡宾的C-H插入反应,然而,需要分离出化学当量的铁卡宾后,再在高温条件下进行反应,并没有实现催化剂量的C-H插入反应。
技术手法
White等人认为以前的报道中[1]没有实现催化量的C-H插入是因为在高温条件下重氮酯的分解和游离卡宾反应是相互竞争的[2]。因此他们认为如果可以通过改变底物的立体位阻与电子密度,使得形成的铁卡宾能够在温和的条件下进行的话,就不会产生竞争性的副反应,这样就能够实现催化量的铁卡宾的插入反应。
主张的有效性验证
①初期讨论
作者通过筛选重氮酯与铁催化剂的反应性,发现立体位阻小的底物容易发生二聚化,而立体位阻大的底物容易转化成酮。另外对于双吸电子基团取代的重氮化合物,如果是酯取代型的底物,无法进行反应。而砜取代型底物与铁(III)酞菁的组合生成了3%的C-H插入产物。然后加入counter anion BArF4后,并且缓慢滴加底物,产率提高到了53%。单独使用铁催化剂或者NaBArF4的话,反应无法进行。
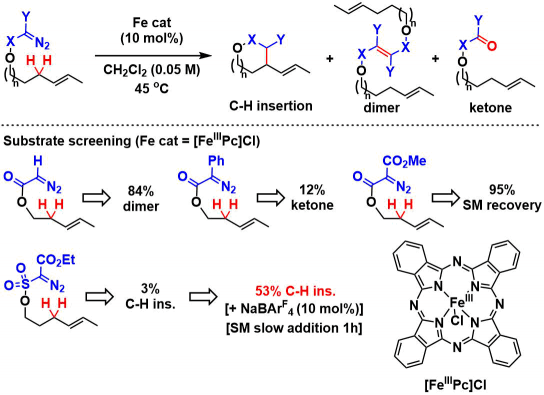
②底物拓展
反应在烯烃α位,甲硅烷基醚α位,苄基位等处可以得到中等产率的产物。当底物中R是富电子取代基的时候,产率有提高的倾向。在使用可能产生环丙烷化产物(6元环)与C-H插入产物(5元环)的底物时,反应选择性的进行C-H插入得到5元环的产物。对(+)-Tocopherol由来的底物实现了Late-stageC-H插入。
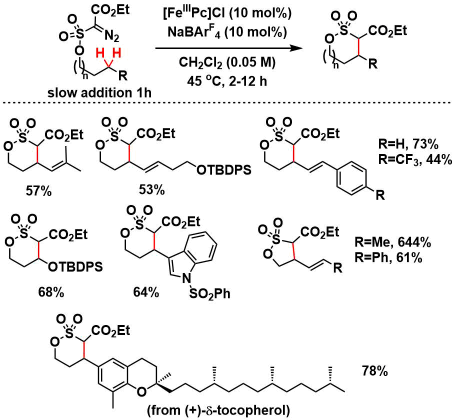
③反应机理的考察
作者认为铁催化剂与重氮底物形成铁卡宾后发生homolysis切断C-H键,然后碳自由基之间形成碳碳键。
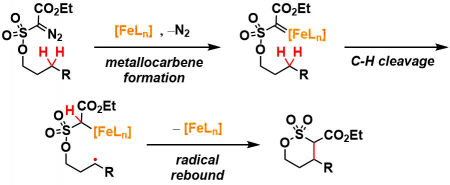
对于上述假说,作者们进行了以下实验的验证。
A) 游离卡宾的否定
重氮酯在二氯甲烷溶剂中,无催化剂条件下,仅仅通过紫外辐照可以产生游离卡宾物质与二氯甲烷发生C-H插入反应。而另一方面,在使用铁(III)酞菁的反应中,没有得到该产物,因此作者否定了该反应是经由游离卡宾进行的。
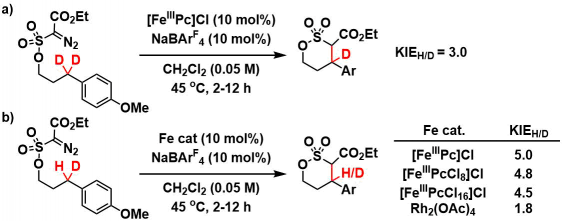
B) 动力学同位素效应(KIE)
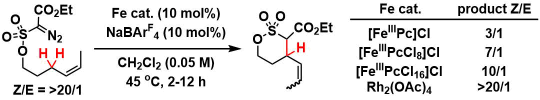
通过下述氘代底物的反应动力学对比,作者认为rate determination step在C-H插入那一步(式a)。对比分子内H/D的竞争性插入反应、可以发现随着配体酞菁上取代的氯的个数不同,得到的KIE值也不同。从这个结果可以认为该C-H插入反应与铁催化剂是相关的。继而在使用Rh2(OAc)4作为催化剂的时候KIEH/D的值变小(1.8),这个巨大的差异也表明,在使用铁催化剂的该体系并不是与铑催化一样是协同反应,而是阶段性的自由基反应(式b)[3]。
C) 烯烃异构化实验
Z-型烯烃底物,在Rh2(OAc)4催化剂作用下立体构型不变(协同反应)、而在使用铁(III)酞菁催化的条件下形成了E-型烯烃。这也能从侧面证明该反应区别于普通铑催化体系,是通过阶段性的自由基反应机理进行的。同时当酞菁配体上的Cl取代个数增加的话,异构化率就变小,这是由于吸电子基团的增多导致铁卡宾变得不稳定,从而使得C-C成键更快。
Comment
- 可能由于铁卡宾的反应性比较差,因此底物中常需要有强吸电子基团。「卡宾自由基」形式的反应性的验证,还需要有更多的实例。
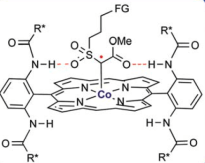
- Zhang等人利用Co催化剂形成Co-卡宾自由基[4]中间体,该中间体通过配体与底物之间的氢键,稳定中间体从而实现了温和条件下的C-H插入反应。而类似的在使用铁催化剂的该反应体系下,是否也能够通过配体的设计来实现类似的中间体的分子内氢键从而加速反应?
参考文献
- Li, Y.; Huang, J.-S.; Zhou, Z.-Y.; Che, C.-M.; You, X.-Z. J. Am. Chem. Soc. 2002, 124, 13185. DOI: 10.1021/ja020391c
- Tortoreto, C.; Rackl, D.; Davies. H. M. L. Org. Lett. 2017, 19, 770. DOI: 10.1021/acs.orglett.6b03681
- Nakamura, E.; Yoshikai, N.; Yamanaka, M. J. Am. Chem. Soc. 2002, 124, 7181. DOI: 10.1021/ja017823o
- (a) Zhu, S.; Xu, X.; Perman, J. A.; Zhang, X. P. J. Am. Chem. Soc. 2010, 132, 12796. (b) Cui, X.; Xu, X.; Jin, L.-M.; Wojtas, L.; Zhang, X. P. Chem. Sci. 2015, 6, 1219. doi:10.1039/C4SC02610A
- Engelmann, X.; Monte-Pérez, I.; Ray, K. Angew. Chem. Int. Ed. 2016, 55, 7632. DOI: 10.1002/anie.201600507
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




















No comments yet.