概要
烯烃-烯酮间的加成环化反应,是构筑环丁烷骨架的一种很有效的手法。由于烯酮通常不稳定,所以往往在体系中生成,直接参与反应的情况比较多。并且分子内反应比较常见。
基本文献
- Staudinger, H. Chem. Ber. 1905, 38, 1735. doi:10.1002/cber.19050380283
- Wilsmore, N. T. M. J. Chem. Soc. 1907, 91, 1938.
- Chick, F.; Wilsmore, N. T. M. J. Chem. Soc. 1908, 946.
<Reviews>
- Ranganathan, S.; Ranganathan, D.; Mehrotra, A. K. Synthesis 1977, 289. DOI: 10.1055/s-1977-24362
- Hyatt, J. A.; Reynolds, P. W. Org. React. 1994, 45, 159. doi:10.1002/0471264180.or045.02
- Tidwell, T. T. Angew. Chem. Int. Ed. 2005, 44, 5778. DOI: 10.1002/anie.200500098
- Tidwell, T. T. Ketenes, 2nd ed., Wiley interscience, Hoboken, NJ, 2006.
- Tidwell, T. T. Eur. J. Org. Chem. 2006, 563. DOI: 10.1002/ejoc.200500452
- Allen, A. D.; Tidwell, T. T. Eur. J. Org. Chem. 2012, 1081. DOI: 10.1002/ejoc.201101230
開発の歴史
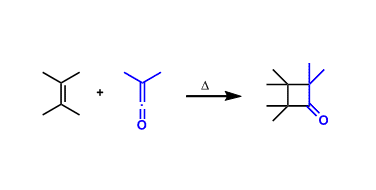
1902年Wolff报道了Wolff重排反应首次合成烯酮,当时的技术水平没有阐明烯酮的形成机理。另一侧,1905年Hermann Staudinger(1953年诺贝尔奖得主)在一次偶然的过程中首次得到了稳定烯酮(二苯基烯酮)。接着在1907年,Wilsmore在铂金作用下加热无水醋酸也得到烯酮产物。
 Hermann Staudinger
Hermann Staudinger
反应机理
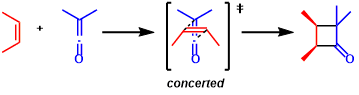
本反应按照协同的[2+2]反应机理进行。烯烃跟烯酮按照下图所示的相互位阻影响最小的交叉接近的方式进行协同反应。因此cis-烯烃相比于trans-烯烃具有更高的反应性。(参考: J. Org. Chem. 1980, 45, 4483.)
反応例
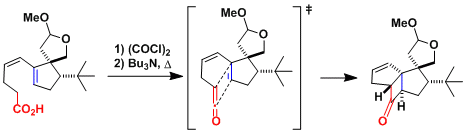
Ginkgolide B的合成[1]:本反应通过高位阻的t-叔丁基控制反应的非対映选择性。
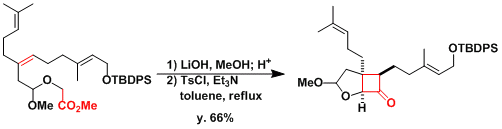
Antheliolide A的合成[2]
一般来说烯酮与二烯之间优先发生[2+2]加成反应、乙酰氧基丙烯腈可以作为烯酮的等价体发生Diels-Alder反应。[3]

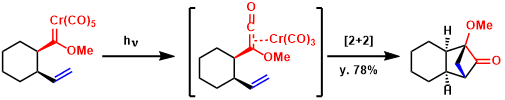
铬费舍尔卡宾在光照条件下在体系中生成烯酮,用于分子内反应。[4]
实验步骤
烯酮的形成手法:酰卤化物在高位阻的碱作用或者α-卤代酰卤化物在还原条件下形成烯酮。烯酮二聚体在光照或者加热条件下分解也能形成烯酮。并且Wolff重排也是形成烯酮的一种方法。
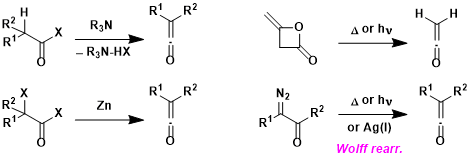
实验技巧
参考文献
[1] Corey, E. J.; Kang, M. C.; Desai, M. C.; Ghosh, A. K.; Houpis, I. N. J. Am. Chem. Soc. 1988, 110, 649. DOI:10.1021/ja00210a083[2] Mushti, C. S.; Kim, J.-H.; Corey, E. J. J. Am. Chem. Soc. 2006, 128, 14050. DOI: 10.1021/ja066336b
[3] Bartlett, P. D.; Tate, B. E. J. Am. Chem. Soc. 1956, 78, 2473. DOI: 10.1021/ja01592a035
[4] Moser, W. H.; Hegedus, L. S. J. Am. Chem. Soc. 1996, 118, 7873. DOI: 10.1021/ja9537585
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!












No comments yet.