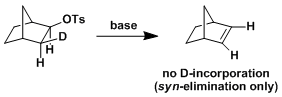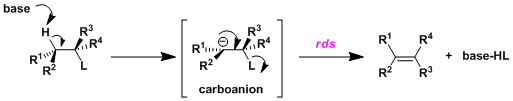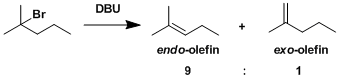概要
消除反应(Elimination Reaction)通常定义为从一个分子中失去部分原子或者官能团,形成多键的反应。 离去基团链接的碳(α碳)的邻位(β位)的氢被脱氢后一起离去的反应被称为β消除反応,拔氢的氢与离去基在同一个碳上的消除反应被称为α消除反应。通过α消除反应可以生成卡宾。
基本文献
反応机理
<β消除的分类>
脂肪族碳氢的β消除反应的机理,根据其分类差别还是很大的。
①单分子消除反应(E1反应)
・与SN1反应一样,首先离去基团解离后形成碳正离子中间体,然后碱再拔去β氢的分两步走的机理。 ・ 一般情况下离去基团的解离过程是该反应的限速阶段。反应速度只与底物的浓度有关(与碱的浓度无关)。 ・根据反应条件可能竞争性的伴有SN1反应或者碳正离子的重排反应(Wagner-Meerwein重排)的副产物。
・在碳正离子中间体十分稳定的情况下,容易发生异构化,因此该反应不利于立体选择性的控制。 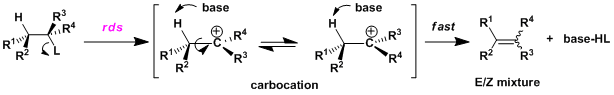
②二分子消除反应(E2反应)
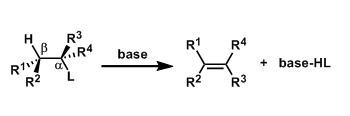
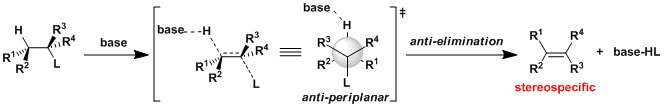
・碱的拔氢与离去基的解离同时进行(协同的)的情况,被称为E2反应。 ・反应速度与底物跟碱的浓度相互依存。 ・α碳与β碳之间可以自由旋转的时候,离去基L与β在同一平面并且是anti的立体位置(antiperiplanar)情况下进行消除反应(anti消除)。这样由于轨道的重叠是最大的所以有利于π的形成。反应具有立体特异性。 ・在使用小位阻的碱拔氢的条件下,经常会伴随有竞争性的亲核取代(SN2反応)副反应。
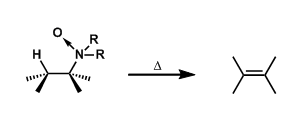
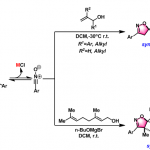
・当底物的构型自由度比较低,比较难翻转形成anti-periplanar构型或者比较难进行分子间拔氢的情况下,也有可能进行synperiplanar消除反应(syn消除)。而在消除反应发生的时候,底物的轨道重叠也是尽可能达到最大化来辅助消除反应的进行,下图中给出了一个实例。
③共轭碱单分子消除反应(E1cB反应)
・区别于上述两种主要的消除反应、该机理首先底物上的β氢被碱拔去后生成碳副离子中间体,然后离去基团作为阴离子离去并且形成双键的机理(具体参照下图)。这种顺序的消除反应被称为E1cB反应,一般情况下离去基L的解离是该反应的限速阶段。
热力学控制的立体选择性遵循Zaitsev法则,也就是生成取代数多的烯烃产物(参考:Angew. Chem. Int. Ed. 2009, 48, 5724.)。该法则也被称为Markovnikov法则的你法则。另外取代基多的烯烃热力学稳定的理由,可以通过超共轭机理进行解释。简单的说就是烯烃的π*轨道被越多的取代基的σ轨道的电子影响(共有倾向)的话,越稳定。
但是也有例外,在离去基是高位阻的四级胺基正离子的情况,或者使用大位阻的t-BuO–等碱的情况,生成的产物就不遵循Zaitsev法则,一般生成逆法则的产物(Hofmann消除)。
反应实例
实验步骤
实验技巧
参考文献
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载