- 概要
格利雅试剂(格氏试剂)是最常用的金属有机试剂,用它能给大多数羰基化合物中引入烷基,转变成相应的醇,(利用格氏试剂合成烃、醇、醛、酮、羧酸等一系列有机化合物的这些反应称格利雅反应,简称格氏反应)。
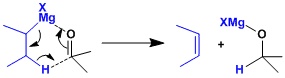
格氏试剂因其碱性强,容易烯醇化的底物在反应中收率低。当引入含β-H的烷基时,伴随酮的氢负离子还原的副产物。
卤代烷烃与羰基化合物的混合溶液在金属镁的存在下,生成醇的反应称为巴比耶(Barbier)反应。使用的金属除了镁以外,金属锂,锌,钐等多种金属也能发生该反应。
根据反应底物的不同,反应名称也有所不同。反应底物为β-氨基-α,β-不饱和酮时称为Berary反应;为原酸酯时称为Bodoroux-Chichibabin醛合成反应;为甲酰胺时称为Bouveault醛合成反应。
格氏反应的发现者V.Grignard因此获1912年诺贝尔化学奖。
- 基本文献
・Grignard, V. Compt. Rend. 1900, 130, 1322.
Primitive Review:
・Shirley, D. A. Org. React. 1954, 8, 28.
・Huryn, D. M. Comprehensive Organic Synthesis 1991, 1, 49.
Recent Progress & Reviews:
・Franzen, R. G. Tetrahedron 2000, 56, 685. doi:10.1016/S0040-4020(99)00963-1
・Hoffmann, R. W. Chem. Soc. Rev. 2003, 32, 225. doi: 10.1039/b300840c
・Garst, J. F.; Soriaga, M. P. Coord. Chem. Rev. 2004, 248, 623. doi:10.1016/j.ccr.2004.02.018
- 反应机理
如以下的schlenk平衡,溶液中存在几种组分
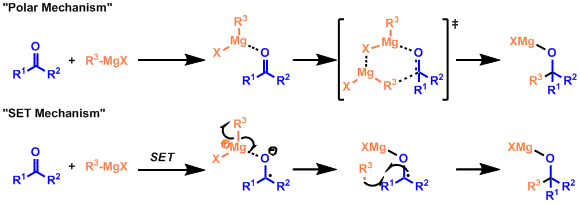
镁作为lewis酸,促进烷基的亲核加成是该类反应的一般机理。像苯酚一类的容易被还原的底物,用大位阻的叔丁基格氏试剂时,反应则通过单电子转移机理而进行。
- 反应实例
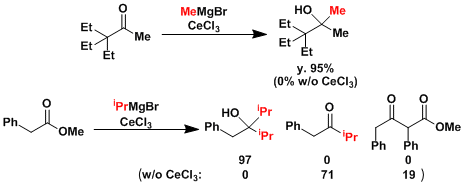
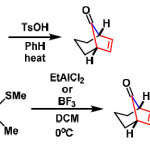
无水氯化铈存在下,烯醇化、还原、1,4-加成等副反应受到抑制,以较好的收率生成加成产物醇 [1]
若通过格氏试剂引入异丙基(i-Pr)基,β-H负离子还原则容易发生。(异丙基格氏试剂加成-加氢取代过程),相反,若想还原位阻较大的酮,可以使用异丙基或叔丁基格氏试剂。
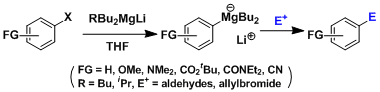
有机镁酸盐的制备,对于通常的格氏试剂,有较好的官能团适应性。[2]
腈化物反应活性较差,需要高温条件。由反应得到的亚胺镁盐难与格氏试剂反应,是反应停留在这一阶段,中间体容易加水分解生成酮。
不对称的(手性)格氏试剂的合成方法也正在探索研究。[3]
在低温条件下用异丙基溴化镁的卤素-金属交换,是制备含官能团的格利雅试剂的有效方法。加入LiCl能够促进该金属交换过程(称作Turbo 格氏试剂)[4]
最近,石原等人报道了通过添加催化剂量的氯化锌的反应条件抑制副反应,高效的发生羰基亲核加成。推测反应中的活性中间体是与镁发生金属交换后生成的三烷基锌负离子。[5]
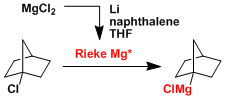
用现制的活性Rieke镁可以与活性较差的卤代烷烃反应生成相应的格氏试剂。[7]
- 实验步骤
- 实验技巧
简单的格氏试剂均有市售试剂。需冷藏,若浓度大容易结晶或沉淀,因此需在适当浓度溶液中保存,或待沉淀完全溶解再使用。
镁表面若被钝化,会阻碍格氏试剂的生成,可用稀盐酸洗净镁表面来活化,或者在手套箱中对镁表面磨光处理(尤其对于小剂量的反应效果较好)
在反应中加入少量单质碘或二溴乙烷或碘代乙烷与镁一起反应,能够促进格氏试剂的生成,对于难生成格氏试剂的底物,通常会准备带冷凝管的加热装置。除了是放热反应,一旦自由基链引发反应后产物生成,即为自催化反应,注意控制反应平稳进行。
通常,使用THF或醚做溶剂制备格氏试剂,配位性溶剂能稳定格氏试剂,促进其生成。在特定情况下仅用醚作溶剂(Mg和MeI等在THF中会生成Wurtz自偶联产物)
烯丙基格氏试剂等容易发生自偶联的试剂的制备需在严格低温条件下,缓慢的滴加试剂,这些技术操作决定了反应的成败。
滴定格氏试剂很简便,用1,10-邻二氮菲无水甲醇的溶液,溶液变为紫红色标志滴定终点,原理是生成了邻二氮菲-镁配合物显色。[6]
- 参考文献
[2] Ohshima, K. et.al Angew. Chem. Int. Ed. 2000, 39, 2481. [abstract]
[3] Hoffmann, R. W. et al. Angew. Chem. Int. Ed. 2000, 39, 3073. [abstract]
[4] Knochel, P. et al. Angew. Chem.Int. Ed. 2004, 43, 3333. DOI: 10.1002/anie.200454084
[5] Ishihara, K. et al. J. Am. Chem. Soc. 2006, 128, 9998. DOI: 10.1021/ja0628405
[6] (a) Lin, H.-S.; Paquette, L. A. Synth. Commun.1994, 24, 2503. (b) Walson, S. C.; Eastman, J. F.Organometal. Chem. 1967, 9, 165.
[7] (a) Rieke, R. D.; Bales, S. E.; Hudnall, P. M.; Burns, T. P.; Poindexter, G. S. Org. Synth. Coll. Vol. VI, 1988, 845. (b) Sell, M. S.; Klein, W. R.; Rieke, R. D. J. Org. Chem. 1995, 60, 1077.
- 相关书籍
- 相关链接
・グリニャール試薬 (Wikipedia:日本)
・ヴィクトル・グリニャール (Wikipedia日本)
・Victor Grignard (Wikipedia)
・Grignard Reagent (Wikipedia)
・グリニャール試薬 (Wikipedia:日本語)
・Grignard Reaction/Grignard Reagent (organic-chemistry.org)
・Rieke Metals (Wikipedia)
・An introduction to Grignard reagents
・Grignard Reagents
・Grignard and Organozinc Reagent (PDF; sigma-aldrich)


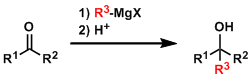
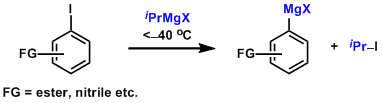
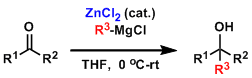















No comments yet.