作者:炸鸡
上一期《走进消除反应Elimination Reactions(1)——怎样让消除反应发生?》笔者谈到有些卤代烃是既可以发生消除反应也可以发生取代反应,通过选择不同的亲核试剂或调节温度可以使得消除反应或取代反应成为主反应。这一期笔者将把重心转移到消除反应上,探讨不同的消除反应机理之间有哪些差别。
E1和E2机理概述
在亲核取代反应中,根据反应机理的不同可以分为SN1反应和SN2反应。类似的,消除反应根据反应机理的不同分为E1反应和E2反应。E是Elimination Reactions的首字母大写,E1和E2里的1和2则寓意着各自反应机理的差别。
E1中的1指代这个反应机理是单分子反应机理。反应机理:离去基团离去,然后β位的质子被脱掉,形成双键,产物生成(图1)。
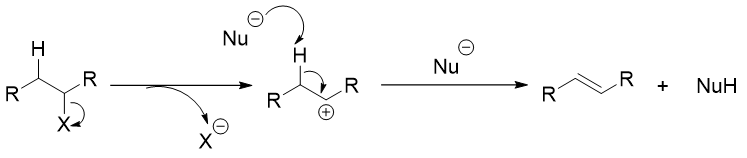
图1. E1机理
E2中的2指代这个反应机理是双分子反应机理。反应机理:亲核试剂(在E2里更具体一点为碱)夺取β位的质子和离去基团离去同时发生,形成双键,产物生成(图2)。
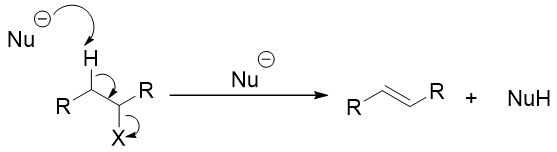
图2. E2机理
在E1机理的反应中,离去基团离去后,原来的反应物变成了一个含碳正离子(carbocation)的化合物,碳正离子非常以及极其活泼,碳正离子就好像反应溶液中的“躁动分子”,只要它一旦生成,它就会不管三七二十一立即与它周围任何可以反应的物质发生反应或是迅速发生重排。所以对于E1机理的反应来说,只要碳正离子生成,反应几乎是瞬间结束的(图3),所以决定E1机理的反应的速度的只有离去基团。离去基团离去的慢,反应速度就慢;反之,离去基团离去地快,反应速度就快。
Rate(E1)=k[RX]
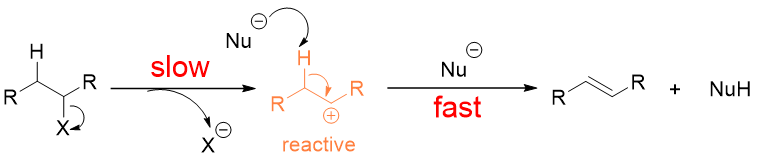
图3
在E2机理的反应中,亲核试剂(对E2里更具体一点为碱)的进攻和离去基团的离去是同时发生的,不存在碳正离子。如果亲核试剂是个强碱或离去基团离去的很快,那么反应速度就会变快。所以决定E2机理的反应的反应速度有离去基团和亲核试剂两个因素。
Rate(E2)=k[RX][base]
哪些条件会促成E1机理
①如上文所讲,碳正离子的生成对E1机理的反应至关重要。只要能生成相对稳定的碳正离子,那么反应机理就倾向于变成E1。那么什么样的碳正离子才算是稳定的呢?这要从碳正离子的结构说起:一般的饱和碳是sp3杂化,碳正离子的碳是sp2杂化,空的p轨道垂直于其他C-H键所在的平面。sp2杂化意味着不再是“金字塔”状的共价键排布,而是“螺旋桨”状的共价键排布(三个桨叶共平面)(图4)。
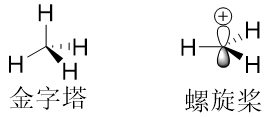
图4. 饱和碳(右)正离子碳(左)
碳正离子的空的p轨道需要临近的其他基团向它“输送”电子,让碳正离子的空的p轨道不那么“缺电子”从而变得更稳定。
a)与烷基相连的碳正离子会比较稳定。例如图5所示,碳正离子与三个甲基相连,每个甲基上总有一个C-H键能大致与碳正离子的p轨道平行,能与碳正离子的p轨道平行的那个C-H键上的σ电子会“涌入”p轨道,进而稳定碳正离子(图5)。
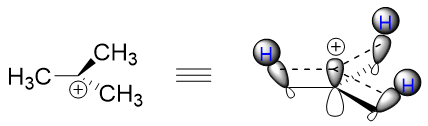
图5. 一个稳定的碳正离子
b) 如果碳正离子的ɑ位有可以让碳正离子的p轨道离域的π电子(图6),碳正离子也会得到稳定。此时三个p轨道(两个满,一个空)组成了一个分子轨道,新组成的分子轨道相较原本的原子轨道拥有更低能量的HOMO,也就更稳定了。
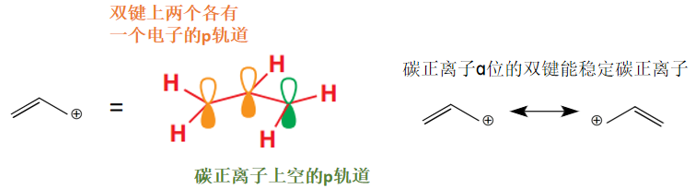
图6
c) 有富电子的芳香环(对位或邻位有给电子基)与碳正离子的p轨道形成共轭,那么碳正离子也会稳定。
d) 如果碳正离子与有孤对电子的杂原子相连,孤对电子会进入碳正离子空的p轨道,稳定碳正离子。即使碳正离子是伯碳,也很稳定(图7)。
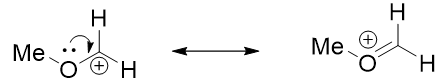
图7
下面是几例稳定的碳正离子和不稳定的碳正离子(图8):
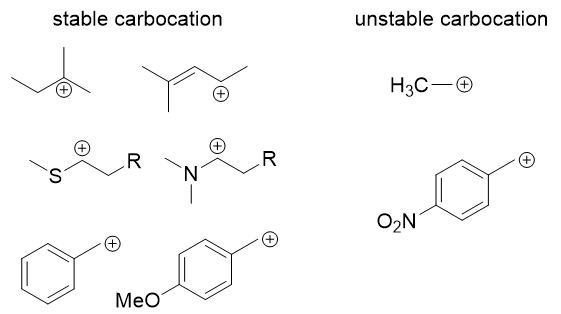
图8
能够形成稳定碳正离子的底物被认为是利于E1机理发生。
②除了产物的结构可以稳定碳正离子外,反应溶剂的选择也十分重要。极性溶剂是利于E1机理发生的,因为极性溶剂能很好地稳定碳正离子。
③E1反应速率与离去基团有关(Rate(E1)=k[RX])。如果离去基团的离去能力很好再加上弱碱甚至没有碱,E1反应会发生。
④最后一个最简单——酸性条件。这很容易理解,如果离去基团是-OH(消除反应里的离去基团除了卤素原子外还有很多),在碱性条件下-OH是永远没法离去的,只有在酸性条件下被质子化形成-O+H2后离去。既然反应条件为酸性,E2机理是绝对不可能了因为E2反应的发生需要碱的进攻和离去基团同时发生。所以酸性条件下的消除反应的机理通通为E1机理。(图9)
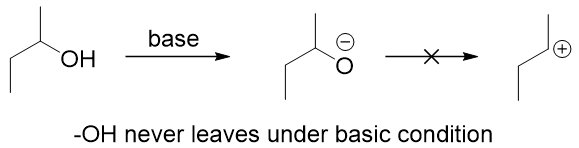
图9
哪些条件会促成E2机理
E2反应的反应速率=k[RX][base]。要想E2反应发生,必须确保亲核试剂(在E2里具体为碱)有足够强的能力夺取质子且离去基团又足够快速地离去。所以使用强碱+强离去基团的组合利于E2反应的发生。和亲核取代不同的是,E2反应的发生不限定于特定的底物结构,许多可以发生E1反应的化合物只要加以强碱一样可以变为E2反应。
注意:E1,E2和SN1,SN2之间没有一点关系
有一些同学会把E1,E2和SN1,SN2之间强行关联起来,认为可以发生SN1的底物会发生E1消除反应,认为可以发生SN2的底物会发生E2消除反应。这是个误区,E1,E2和SN1,SN2之间没有一点关系。反例如下(图10):
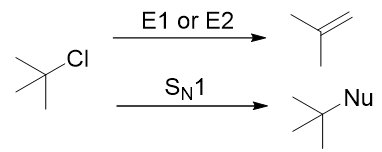
图10
氯代叔丁烷既可以发生E1消除反应,也可以发生E2消除反应(取决于碱的强弱),但由于氯代叔丁烷ɑ-碳的周围有太多甲基造成位阻太大,所以只能发生SN1亲核取代反应。
E1cB机理
当离去基团先离去,碱夺质子很慢,反应机理为E1;当离去基团和碱夺质子同时发生时,反应机理为E2。那么,如果当碱的碱性很强以至于先夺取了质子,离去基团再离去会发生什么呢?——这就是E1cB机理(图11)。
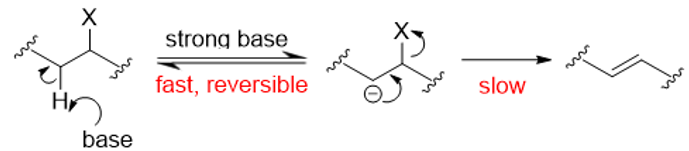
图11. E1cB机理
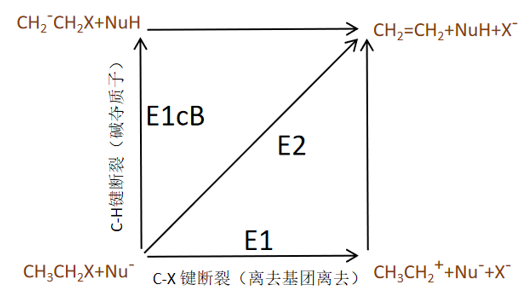
图12. E1,E2,E1cB三者之间的关系(图片改编自[2])
当强碱先夺取β位的质子后,碳负离子生成,而后碳负离子迫使离去基团离去。当β位碳负离子很稳定(旁边有吸电子基如硝基羰基)且碱为强碱(如果碱的碱性不足以脱去β位的质子,E1cB反应就不会发生)时,反应机理偏向于E1cB机理。
Rate(E1cB)=k[RX][base]
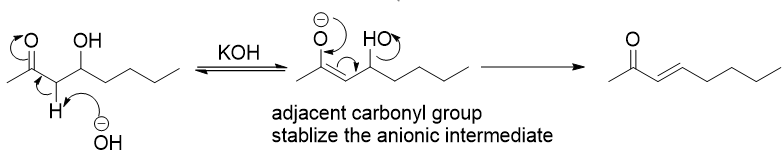
图13. 一个E1cB机理的反应
学有余力
我们所说的E1机理,E2机理,E1cB机理描述的都是一种极端的情况,在现实中的消除反应中,反应的机理多是介于极端机理的中间机理,例如现实中用的最多的是“偏向于”“倾向于”。例如这个反应机理偏E1机理,或这个反应机理位于或处于E1机理和E2机理之间。
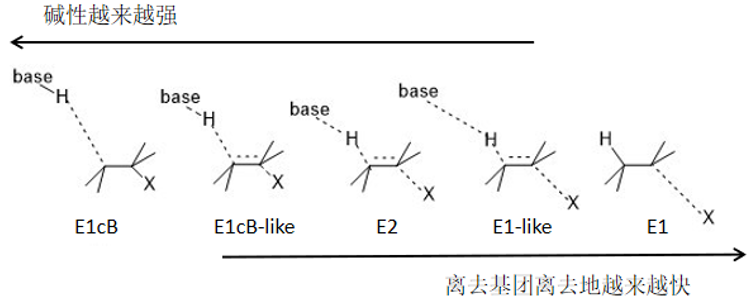
图14(图片改编自[2])
参考文献
[1] J. Clayden, N. Greeves, S. Warren, 2012. Organic Chemistry. Great Clarendon Street, Oxford: Oxford University Press. 1187pp. 2nd edition. [2] F. A. Carey, R.J. Sundberg, Advanced Organic Chemistry Part A: Structure and Mechanisms.封面图片来自:Image by <a href=”https://www.freepik.com/free-vector/science-lab-with-objects_7405691.htm#query=chemical%20reaction&position=7&from_view=keyword&track=ais&uuid=c9ebc29e-3e39-4c5d-8000-993a1cf63f69″>Freepik</a>
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.














No comments yet.