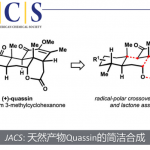
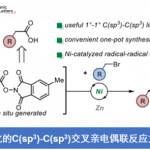
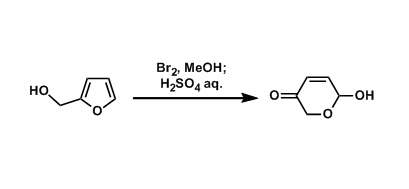
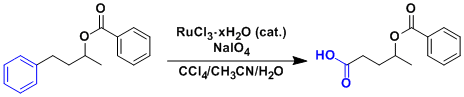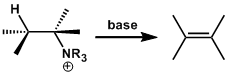概要
超强的氧化剂。通常的氧化剂实现不了的苯环烯烃的氧化裂解可以在此氧化剂参与的温和条件下实现。此方法也可以作为臭氧氧化的替代法来使用。
但是底物中有不耐氧化的官能团来说,会首先被氧化,所以经常导致副反应的生成。很少对底物有选择性,使用的时候需要多多考虑。
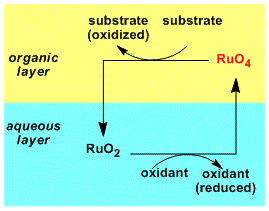
因为四氧化钌很贵,所以往往使用催化量的前体和便宜的再氧化剂在体系中形成Ru(VIII)的方法。溶剂的话经常使用不与反应试剂反应的四氯化碳。另外,四氧化钌会与醚类溶剂剧烈反应。如果底物能跟氧化剂配位的话,氧化剂就会失活。但是可以利用添加配位性混合溶剂比如乙腈的方法来防止。综上所述、RuCl3(cat.)-NaIO4/CH3CN-CCl4-H2O 二相体系是用的最多的。
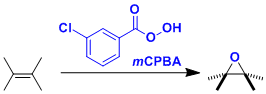
如上图所示的,缺点子的芳香环通常是不会被氧化的。
基本文献
・実験化学講座第4版 「酸化反応」 3・2
反应机理
首先溶解在有机相中的RuO4不断地被消耗生成水溶性的RuO2转移到水层中。再在水层中被再氧化剂氧化生成RuO4回到有机相中。按照此种方法进行的催化氧化反应。
反应实例
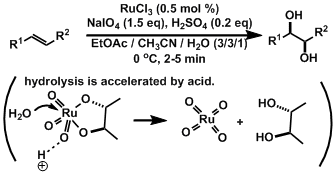
例) 烯烃的cis-二羟基化[1]
不用使用毒性强的Os使反应照样能进行。氧化的条件很重要。该反应在极短的时间就完结了。
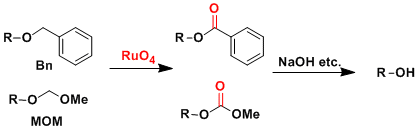
例) MOM、Bn醚的脱保护
此类的保护基是比较强的保护基,一般不使用相对强的酸性条件的话是无法脱去的。在全合成的最终阶段的时候,这种难脱去的保护基经常会带来很多麻烦。
如果使用四氧化钌的话,可以氧化转化成甲基酯,或者苯基酯。然后用比较温和的碱性条件,可以进行选择性的脱保护。
实验步骤
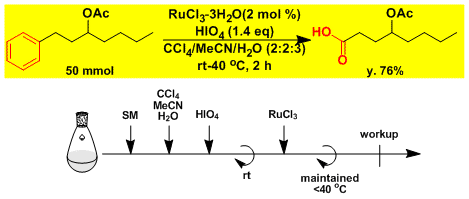
苯环的裂解[2]
※由于生成二氧化碳、所以反应不能密封进行。 ※温度控制(25-40℃で行う)十分重要。 ※Ru的渣可以用短柱子很简便地除去。
实验技巧
参考文献
[1] (a) Plietker,B.; Niggemann, M.; Org. Lett. 2003, 5, 3353. DOI: 10.1021/ol035335a (b) Plietker,B.; Niggemann, M.; Pollrich, A. Org. Biomol. Chem. 2004, 2, 1116. DOI: 10.1039/b316546a[2] Teresa Nunez, M.; Martin, V. S. J. Org. Chem. 1990, 55, 1928. DOI: 10.1021/jo00293a044
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!