本文作者 漂泊
锝是第一种被人工制造的放射性元素,99Tc可以作为放射性药物用于医学成像领域。
锝的基本物理性质
| 分类 | 第ⅦB族▪金属 |
| 原子序号・原子量 | 43(97.9) |
| 电子配置 | 4d55s2 |
| 密度 | 11500kg / m 3 |
| 熔点 | 2172°C |
| 沸点 | 4877°C |
| 色・形状 | 银白色金属 |
| 丰度 | 5×10-16% |
| 发现者 | Ernest Orlando Lawrence,C.Perrier, Emilio Gino Segrè |
| 主要的同位素 | 97Tc, 98Tc, 99Tc |
| 用途例 | 放射性药物,核医学 |
| 前后的元素 | 钼-锝-钌 |
锝的发现
锝是首个以人工方法制得的元素,其主要来源为反应堆中铀裂变产物,这种元素从废核燃料棒中成吨提取。至80年代初还没有在地球上找到天然存在的锝。门捷列夫在建立元素周期系的时候,曾经预言它的存在,命名它为eka-manganese(类锰)。莫斯莱确定了它的原子序数为43。其实,有关这个元素发现的报告早在门捷列夫建立元素周期系以前就开始了。在1846年,俄罗斯盖尔曼声称,从黑色钛铁矿(ilmenite)中发现了这个元素,就以这个矿石的名称命名它为ilmenium,并且测定了它的原子量约104.6,叙述了它的一些性质与锰相似。接着,1877年,俄罗斯圣彼得堡的化学工程师克恩发表发现了一种占据钼和钌之间的新元素报告,其原子量经测定等于100。但它却被另一些化学家证明是铱、铑和铁的混合物。亚洲的化学家们也不甘落后,在1908年,日本化学家小川声称从方钍石中发现这一元素并命名为nipponium;到1924年,又有化学家报告,利用X射线光谱分析从锰矿中发现了这一元素,命名为moseleyum。迟至1925年,德国科学家也宣布,在铌铁矿中发现了这一元素。但这些发现都没有被证实和承认。
于是43号元素被认为是“失踪了”的元素。后来,物理学家们的“同位素统计规则”解释了它“失踪”的缘由。这个规则是1924年前苏联学者苏卡列夫提出来的,在1934年被德国物理学家马陶赫确定。根据这个规则,不能有核电荷仅仅相差一个单位的稳定同量素存在。同量素是指质量数相同而原子序数不同的原子,如Ar-40、K-40、Ca-40都有相同的质量40。由于它们的原子序数不同,所以它们处在元素周期表不同的位置上,因而又称异位素。锝前后的两个元素钼(42)、钌(44)分别有一连串质量数94~102之间稳定同位素存在,所以再也不能有锝的稳定同位素存在,因为锝的质量数应当是在这些质量数之间。
1936年底意大利年轻的物理学家C.Perrier到美国伯克利进修。他利用Ernest Orlando Lawrence发明的回旋加速器并在他的协助下,用氘核照射钼,并把照射过的钼带回意大利帕勒莫大学。在化学系教授Emilio Segrè协助下,经历近半年时间,他们分离出了10-10克的99Tc。最后他们向世界宣布了锝元素的发现。它是第一个用人工方法制得的元素 ,所以按希腊文Technetos(人造)命名为Technetium。新元素的性质与铼非常相似,而与锰的相似程度较差。后来科学家又从铀的裂变产物中得到锝的许多同位素,目前已发现质量数90~110的全部锝同位素。
自然界仅发现了极少量的99Tc。在1962年,B.T. Kenna及P.K. Kurod在非洲的一个八水化三铀矿中,从铀-238的裂变物之中,找到了微量的99Tc。锝长久以来折磨着化学家们,因为不能找到它。我们现在知道它所有的同位素都是放射性的,而且任何来自地球地壳的这种元素的矿物早已衰变。(其寿命最长的同位素的半衰期是4百万年。)即便如此,有些锝原子会在铀发生核裂变产生,一吨铀中只有约1毫克锝。[1-5]
金属锝
欧内斯特·劳伦斯
Ernest Orlando Lawrence是美国著名物理学家,加州大学伯克利分校物理学教授。他于1932年设计和制造第一台高能粒子回旋加速器,并利用回旋加速器研究了很多高能粒子,大量的人造元素也通过回旋粒子加速器加速再进行原子对撞得到。这一发明为物理学和化学的发展做出了突出贡献,Lawrence也因此获得1939年度诺贝尔物理学奖。此外,Lawrence还参与了曼哈顿计划,主管用电磁法分离制造原子弹用的铀-235工作,为第二次世界大战的结束做出了特殊贡献。他还是彩色显像管的发明者及专利持有者。
由于劳伦斯的卓越贡献,化学元素周期表中第103号元素铹(Lawrencium)、劳伦斯伯克利国家实验室(Lawrence Berkeley National Lab)和劳伦斯利弗莫尔国家实验室(Lawrence Livermore National Lab)的两所美国国家实验室都是为纪念劳伦斯而命名的。[6]
Ernest Orlando Lawrence
99Tc
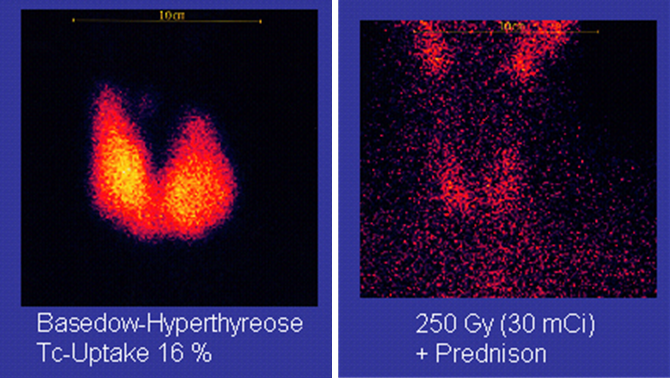
99Tc是一种锝的半衰期极短的不稳定同位素,是核医学临床诊断中应用最广的医用核素,常用99Tc焦磷酸盐注射液用作诊断脏器疾病和功能的放射性显像剂。99Tc放射性药物不仅用于状态图像诊断,而且还可用于功能(如脑、心肌,肝功能等)诊断,已占诊断用放射性显像剂的约85%,可用于诊断脑、心肌和肿瘤等疾病和几乎所有脏器疾病。
医疗工作中使用的绝大多数的99Tc是通过在反应堆中高浓缩铀材料铀-238衰变得到的,该过程的一个缺点是它需要用到放射性的铀-238,而这些材料受到裂变材料安全预防措施的管制。此外,也可以利用99Mo衰变制得99Tc。99Mo 以钼酸盐的形式(MoO4 2- )被吸附到含酸性氧化铝(Al2O3)的99Tc发生器内的屏蔽柱色谱仪中。99Mo的半衰期较短,为67小时,因此衰变产生的99Tc可以不断生产。然后可以通过液相萃取得到可溶性高锝酸盐TcO4–。[7-9]
使用99Tc进行医学成像
锝有机配合物
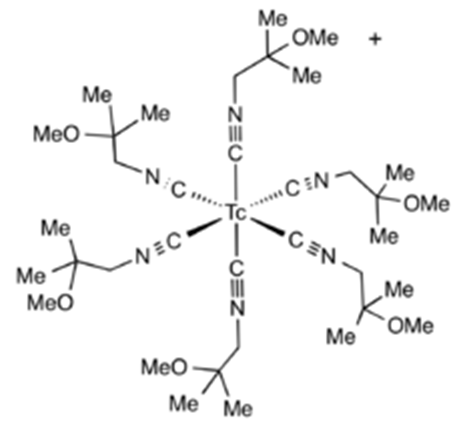
锝能与CO,芳烃以及环戊二烯基等有机配体形成多种配位络合物。许多配合物由于核医学领域具有很好的用途而受到了深入研究。通过Tc-C键可以形成很多有机锝络合物,如 binary carbonyl Tc2(CO)10 是一种白色挥发性的固体。在这个分子中,两个锝原子相互结合,而每个原子又被五个羰基配体所形成的八面体包围。锝原子之间的键长303 pm,明显大于金属锝(272 pm)中两个原子之间的距离。类似的羰基化合物也可以由锝的同系物:锰和铼形成。[10-13]
广泛用于心脏成像的药物Technetium sestamibiis(“Cardiolite”)
参考文献
[1]Jonge; Pauwels, E. K. (1996). “Technetium, the missing element”. European Journal of Nuclear Medicine. 23 (3): 336–44. doi:10.1007/BF00837634. PMID 8599967 [2]van der Krogt, P. “Elentymolgy and Elements Multidict, “Technetium””. Retrieved 2009-05-05. [3] Heiserman 1992, p. 164 [4]Holden, N. E. “History of the Origin of the Chemical Elements and Their Discoverers”. Brookhaven National Laboratory. Retrieved 2009-05-05. [5]Perrier, C.; Segrè, E. (1947). “Technetium: The Element of Atomic Number 43”. Nature. 159 (4027): 24. Bibcode:1947Natur.159…24P. doi:10.1038/159024a0. PMID 20279068 [6]https://en.wikipedia.org/wiki/Ernest_Lawrence [7]”Chapter 1.2: Early Days at the Berkeley Radiation Laboratory”. The transuranium people: The inside story. University of California, Berkeley & Lawrence Berkeley National Laboratory. 2000. p. 15. ISBN 1-86094-087-0. [8]Rimshaw, S. J. (1968). Hampel, C. A., ed. The Encyclopedia of the Chemical Elements. New York: Reinhold Book Corporation. pp. 689–693. [9]Emsley, J. (2001). Nature’s Building Blocks: An A-Z Guide to the Elements. New York: Oxford University Press. pp. 422–425. ISBN 0-19-850340-7. [10] Alberto, Roger (2010). “Organometallic Radiopharmaceuticals”. Medicinal Organometallic Chemistry. Topics in Organometallic Chemistry. 32. p. 219. doi:10.1007/978-3-642-13185-1_9. ISBN 978-3-642-13184-4. [11]Hileman, J. C.; Huggins, D. K.; Kaesz, H. D. (1961). “Technetium carbonyl”. Journal of the American Chemical Society. 83 (13): 2953–2954. doi:10.1021/ja01474a038. [12]Bailey, M. F.; Dahl, Lawrence F. (1965). “The Crystal Structure of Ditechnetium Decacarbonyl”. Inorganic Chemistry. 4 (8): 1140–1145. doi:10.1021/ic50030a011 [13]Schwochau 2000, pp. 286, 328
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




























No comments yet.