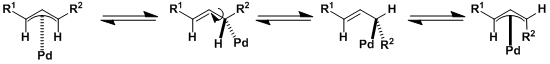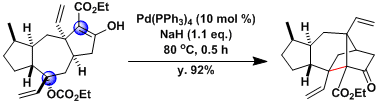- 概要
烯丙基醇以及其衍生物烯丙基卤化物、酯、 碳酸盐,磷酸盐等作为反底物,在零价钯的催化作用下,各种各样的亲核试剂发生取代反应从而导入各种各样的基团,俗称烯丙基烷化(Allylic Alkylation)。
反应物适用范围非常广泛,在温和条件下生成碳碳键的一个有用的方法。
钼、铱等等金属催化剂也能催化类似的反应,而本反应的特点在于内部碳原子发起取代反应,能得到多取代产物。
- 基本文献
・Tsuji, J.; Takahashi, H.; Morikawa, M. Tetrahedron. Lett. 1965, 4387. doi:10.1016/S0040-4039(00)71674-1
・Trost, B. M.; Fullerton, T. J. J. Am. Chem. Soc. 1973, 95, 292. DOI: 10.1021/ja00782a080
・Tsuji, J.; Shimizu, I.; Minami, I.; Ohashi, Y.; Sugiura, T.; Takahashi, K. J. Org. Chem. 1985, 50, 1523. DOI: 10.1021/jo00209a032
・Frost, C. G.; Howarth, J.; Williams, J. M. J. Tetrahedron: Asymmetry 1992, 3, 1089. doi:10.1016/S0957-4166(00)82091-1
・辻二郎, 有機合成化学協会誌 1999, 57, 1036.
- 反应机理
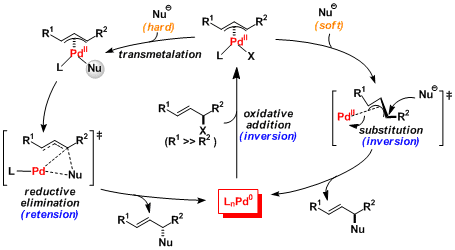
首先反应底物对钯发生氧化加成,生成π-(η3)-烯丙基钯中间体。之后,烯丙基与钯配位的反面受到亲核进攻,得到产物。对于烯丙基而言,通常不活泼的酯或是碳酸盐更利于发生氧化加成。这是由于氧化加成的最开始而言,在参与配位的双键旁边有定位基团对钯的插入更加有利。
通常在氧化加成的步骤和亲核进攻的步骤里整体构型都会发生反转,全过程发生两次反转因此产物还是保持了原来的构型。
值得一提的是在用硬亲核试剂的情况下,反应机理则是硬亲核试剂与钯的转移金属化接着还原消去的顺序进行。在这一亲和加成的阶段构型将会保持,反映总体而言生成物的构型将会发生反转。在这种情况下需要注意的是不要加入磷配体。
取代通常发生在空间位阻最小的碳上。
π-烯丙基钯会经过σ-(η1)-烯丙基钯顺反异构。这一异构化的速度要大于亲核加成发生的速度,生成的烯的顺反结构需要注意。(环状烯丙基醇的情况下不会发生这一异构化,作为底物最为容易取用。)
- 反应实例
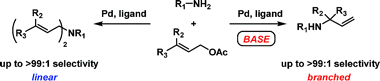
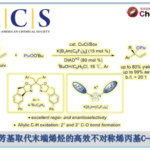
有碱共存的情况、能选择性的得到分支型产物。[1]
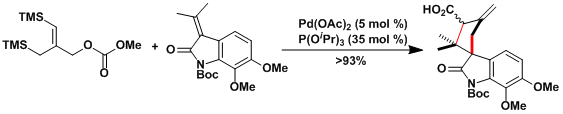
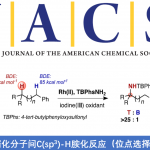
Sordarin的合成[2]:利用分子内辻-Trost反应Vicinal构建四级碳。
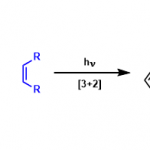
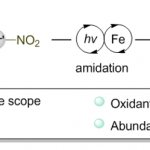
Marcfortine B的合成[3]:甲叉甲烷在钯的作用下、发生[3+2]加成。
- 实验步骤
- 实验技巧
- 参考文献
[1] Dubovyk, I.; Watson, I. D. G.; Yudin, A. K. J. Am. Chem. Soc. 2007, 129, 14172. DOI: 10.1021/ja076659n
[2] Chiba, Y.; Kitamura, M.; Narasaka, K. J. Am. Chem. Soc. 2006, 128, 6931. DOI: 10.1021/ja060408h
[3] Trost, B. M.; Cramer, N.; Bernsmann, H. J. Am. Chem. Soc. 2007, 129, 3086. DOI: 10.1021/ja070142u