导读:
近日,南方科技大学(Southern University of Science and Technology)张绪穆–陈根强课题组利用具有开阔的活性位点的双功能铑催化剂实现了在温和条件下对硝酮化合物的高效不对称氢化以及转移氢化反应,成功得到了一系列N,N-二取代羟胺化合物。克级规模反应和优异的产物衍生化结果表明该反应的应用潜力。机理实验及理论计算成功解释了对映选择性的来源。相关成功发表于 Angew. Chem. Int. Ed.上。
文章链接:
https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.202319662
正文:
手性羟胺广泛存在于多种药物和天然产物中,也可以作为一些功能分子的合成中间体。尽管手性羟胺具有重要意义,但缺乏有效的合成方法,导致人们对这些化合物的进一步认识和应用受限。
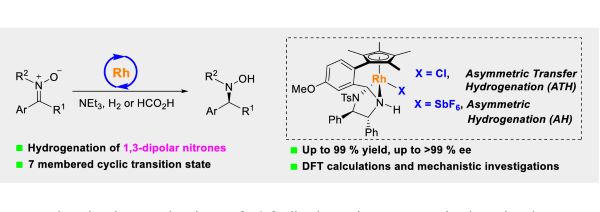
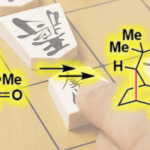
不对称氢化是构建分子手性的最有力的方法之一,特别是不饱和C=C、C=N和C=O双键的不对称氢化。作为一种常见的1,3-偶极子,硝酮的不对称氢化反应与发展十分成熟的极性不饱和化合物的不对称氢化反应本质的不同(Fig. 1)。早在1994年和2000年便由日本科学家Murahashi分别使用Ru催化剂和硅烷作为还原剂,以及使用Ir催化剂在氢气条件下还原硝酮得到手性羟胺,但其对映选择性尚有很大的提高空间。硝酮还原中存在的问题如(1)硝酮独特的1,3-偶极结构(2)硝酮的互变异构和E/Z异构化;(3)硝酮N-O键容易裂解; (4)C=N双键上4个取代基位阻大。使得硝酮的不对称还原长达二十多年没有明显进展。
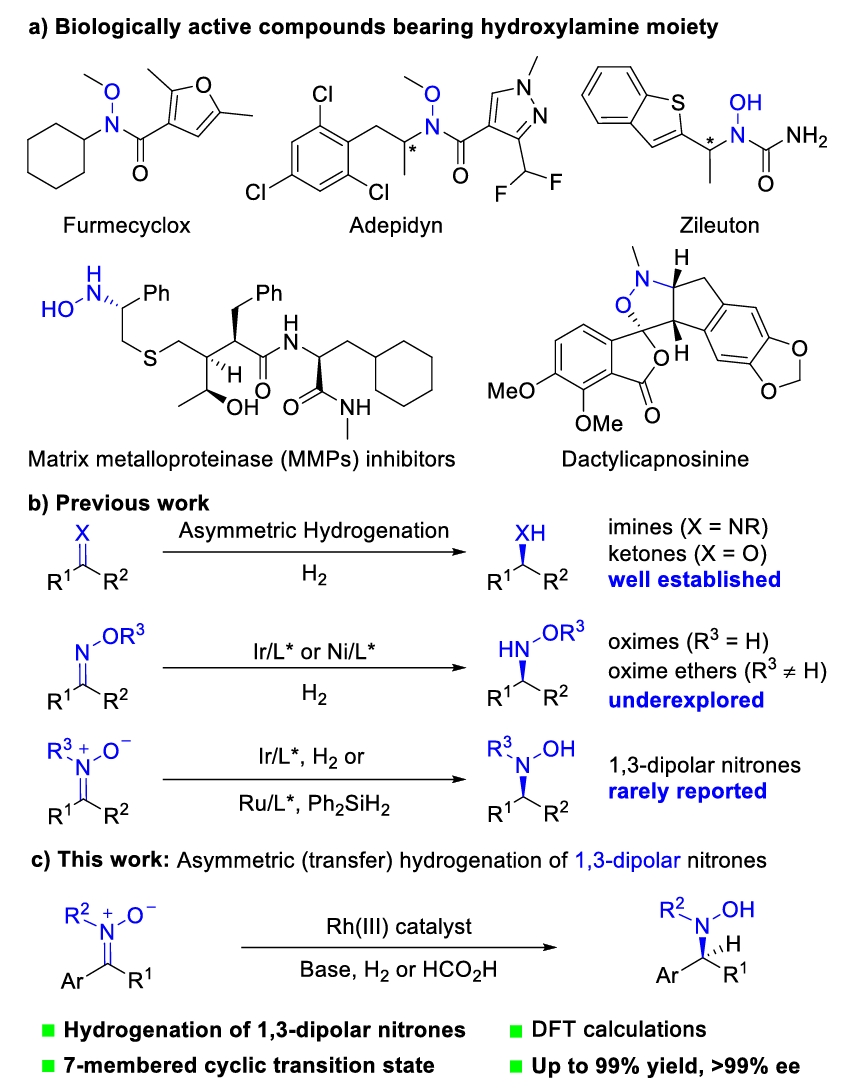
Fig.1. Background of asymmetric hydrogenation of nitrones
为了解决这一问题,经过对底物结构的仔细分析,并基于多年来在不对称氢化领域的经验,作者猜测,使用具有更开阔的活性位点的双功能催化剂,能有效适应硝酮的特殊的结构,进而开发了一个对硝酮化合物高效的不对称还原反应,可得到高达99%的产率和>99% ee的手性羟胺,DFT计算表明其中涉及七元环状过渡态,与常见的酮的不对称氢化中的六元环状过渡态具有异曲同工之妙。
在研究的初始阶段,作者以(E)-1a为模型底物,以HCO2H/NEt3共沸混合物为氢供体,探索硝酮的不对称转移氢化的最佳条件。催化剂Cat1f表现出令人满意的活性和对映选择性,达到了>99%的转化率和90% ee。尽管取得了令人鼓舞的结果,但通过系统探索溶剂和氢供体并不能进一步提高对映选择性。使用纯甲酸作为氢供体,对映选择性降低至70% ee。为了进一步提高对映选择性,作者尝试在非酸性条件下还原硝酮。

Fig.2. [a] Reaction conditions: all reactions were performed with (E)-1a (0.1 mmol), HCO2H/NEt3 azeotropic mixture (20 μL), and catalyst (0.01 M in DCM, 50 μL) in 0.5 mL of solvent at 25 °C for 12 h. Conversions were determined by 1H NMR spectroscopy. Enantiomeric excesses (ee) were determined by HPLC analysis using a chiral stationary phase. [b]HCO2H was used as hydrogen source.
作者继续使用(E)-1a作为模板底物,尝试对不对称氢化反应条件进行优化(Table 1)。当使用Cat2i (0.5 mol%),NEt3(10 mol%)溶解在甲苯 (0.5 mL)中H2(50 bar)常温反应22 h,可以以99%的转化率和97%的ee值获得目标产物(entry11)。弱配位的抗衡阴离子对氢气的活化至关重要。
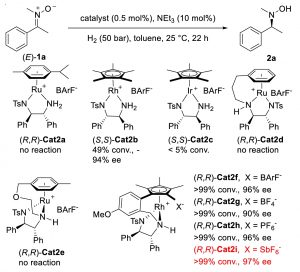
Fig.3. Reaction conditions: all reactions were performed with (E)-1a (0.1 mmol), 10 mol% NEt3, and 0.5 mol% catalyst in 0.5 mL of solvent at 25 °C under 50 bar of H2 for 22 h. The catalyst was prepared in DCM (50 μL for each reaction vial, see supporting information). Conversions (conv.) were determined by 1H NMR spectroscopy. enantiomeric excesses (ee) were determined by HPLC analysis using a chiral stationary phase.
在建立了最佳反应条件后,作者继续研究了硝酮的不对称氢化反应的底物范围(Scheme 2),结果如Fig.3所示。在优化条件下,大部分底物如卤素、烷氧基、烷基、杂环(2a-2r)均能顺利地转化为相应的手性羟胺,产率高,对映选择性良好 。双环底物的反应结果显示,环的大小对对映选择性影响显著(2s-2u, 产率98-99%,77-99% ee)。C=N双键上的烷基取代基的变化没有显著改变反应活性。但在N-芳基取代硝酮(E)-1y的不对称氢化中仅得到了中等的对映选择性(2y,70%产率,60% ee)。刚性的四氢异喹啉衍生的环内硝酮(E)-1z具有较低的活性和对映选择性(2z,12%产率,40% ee),作者猜测可能是由于底物的刚性结构使得C=N双键更难扭曲从而适应过渡态的取向。而对于由苄基丙酮衍生的E/Z混合物(E/Z = 1.2:1)硝酮1aa,几乎获得了消旋的产物2aa。环戊酮和环己酮衍生的硝酮则因为相应的还原产物羟胺的不稳定,仅以中等产率得到产物2ab和2ac。
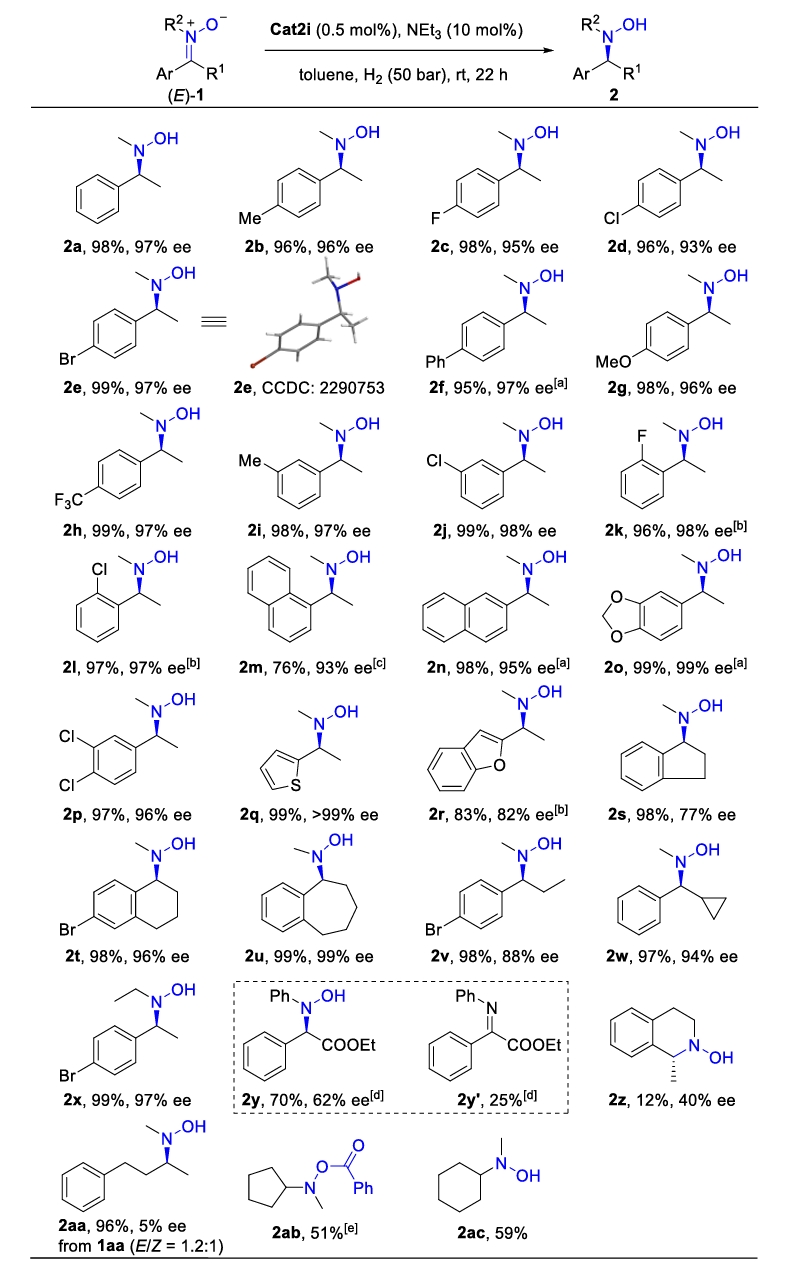
Scheme 2. Substrate Scope. Reaction conditions: unless otherwise noted, all reactions were performed with pure (E)-1 (0.2 mmol), 10 mol% NEt3, and 0.5 mol% catalyst in 1.0 mL of solvent at 25 °C under 50 bar of H2 for 22 h. The catalyst was prepared in DCM (0.1 mL for each reaction vial, see supporting information). Isolated yields. Enantiomeric excesses (ee) were determined by HPLC analysis using a chiral stationary phase. [a] THF, 80 bar, 48 h. [b] 50 °C, 80 bar, 24 h. [c] THF, 50 °C, 80 bar, 48 h. [d] 12 h. [e] The yield was determined after O-benzoylation with NEt3 (1.1 eq) and BzCl (1.1 eq) in DCM (0.2 M) for 4 h.
接下来,作者探索了此转化的合成应用(Scheme 3)。克级规模转化以及后续的衍生化反应证明了这一反应具有潜在的应用价值。
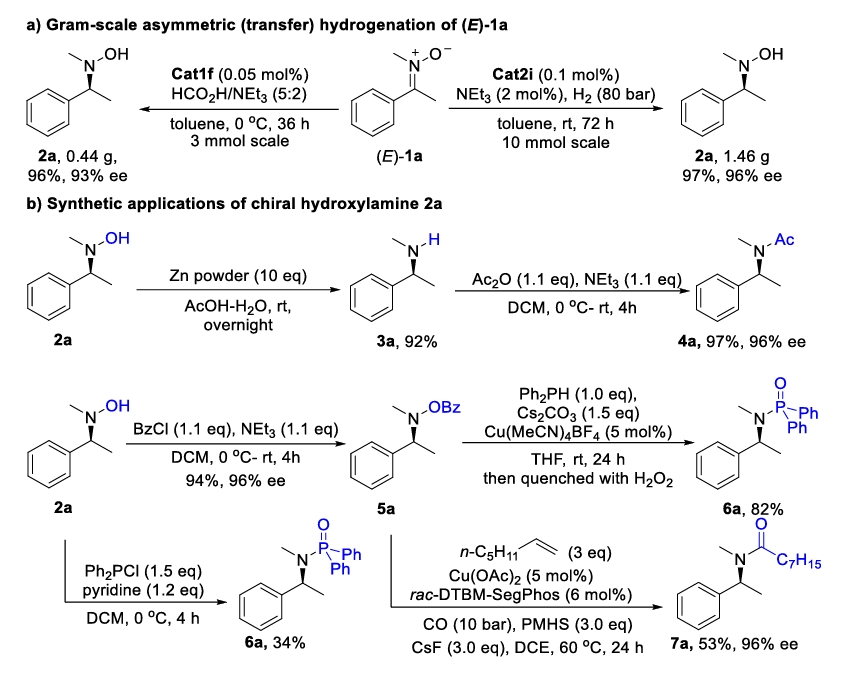
Scheme 3. Gram-scale experiments and synthetic applications.
最后,为了深入理解反应机理,作者进行了一系列控制实验(Scheme 4)。首先,原位加入10 mol% NaBArF,可得到20%转化率和92% ee。而加入1.0当量的Bu4NCl后,转化率显著降低到<5%,表明共价性的Rh-Cl键抑制了氢气的活化(Scheme 4a)。值得注意的是,在反应体系中加入CF3CH2OH反应几乎完全抑制,这可能是因为CF3CH2OH会严重破坏反应过渡态中必要的氢键作用。之后的氘代实验证明了手性碳所连接的氢来自于氢气(Scheme 4b)而非其他物种。在不同酸碱性添加剂的作用下,底物的E/Z异构化行为也一定程度上解释了酸性条件下的转移氢化的对映选择性难以提高的现象(Scheme 4c)。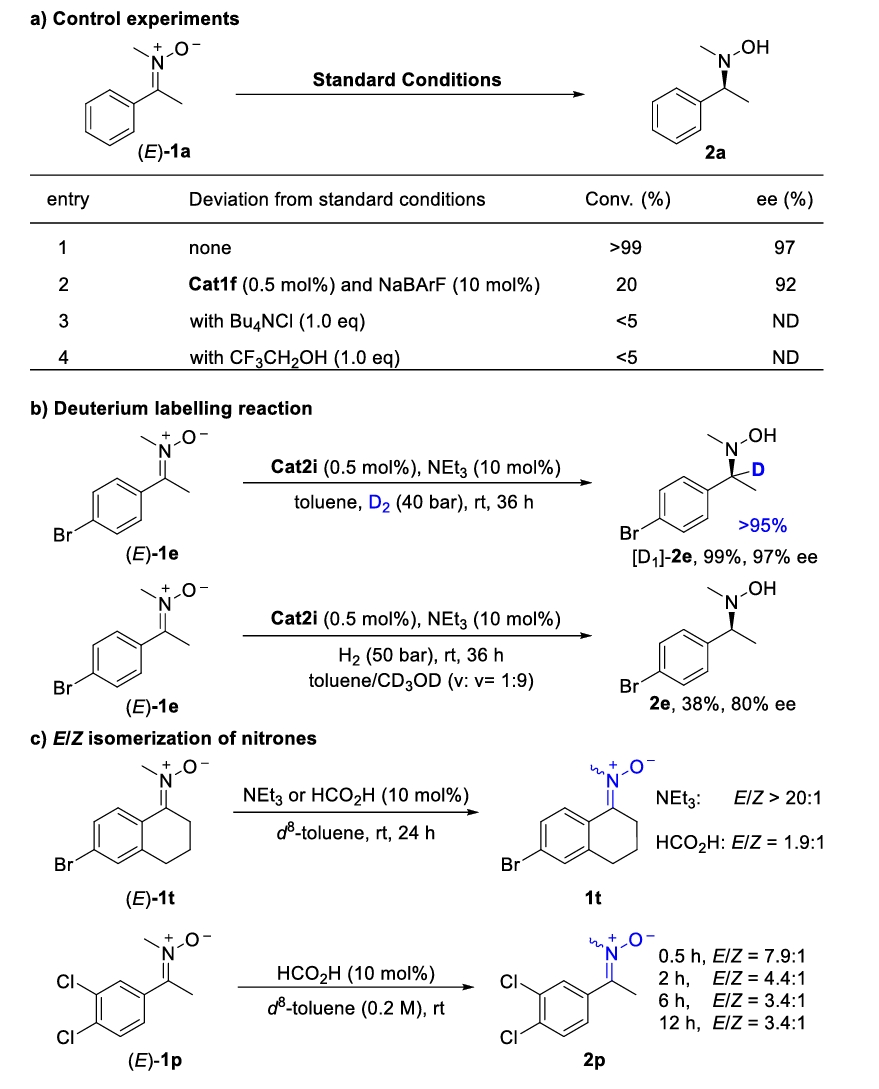
Scheme 4. Mechanistic studies
之后的DFT理论计算证明了正如预期的那样,反应经过七元环状过渡态。底物的取向由催化剂的NH与1a的氧原子之间的氢键控制。首先计算了(E)-1a还原的过渡态,过渡态TS1的能量比过渡态TS2的能量高出2.60kcal/mol,对应98 % ee,这与实验值97 % ee的结果一致。之后的对于(Z)-1a的不对称氢化的计算证明了底物的构型极大地影响对映选择性(Fig. 3)。
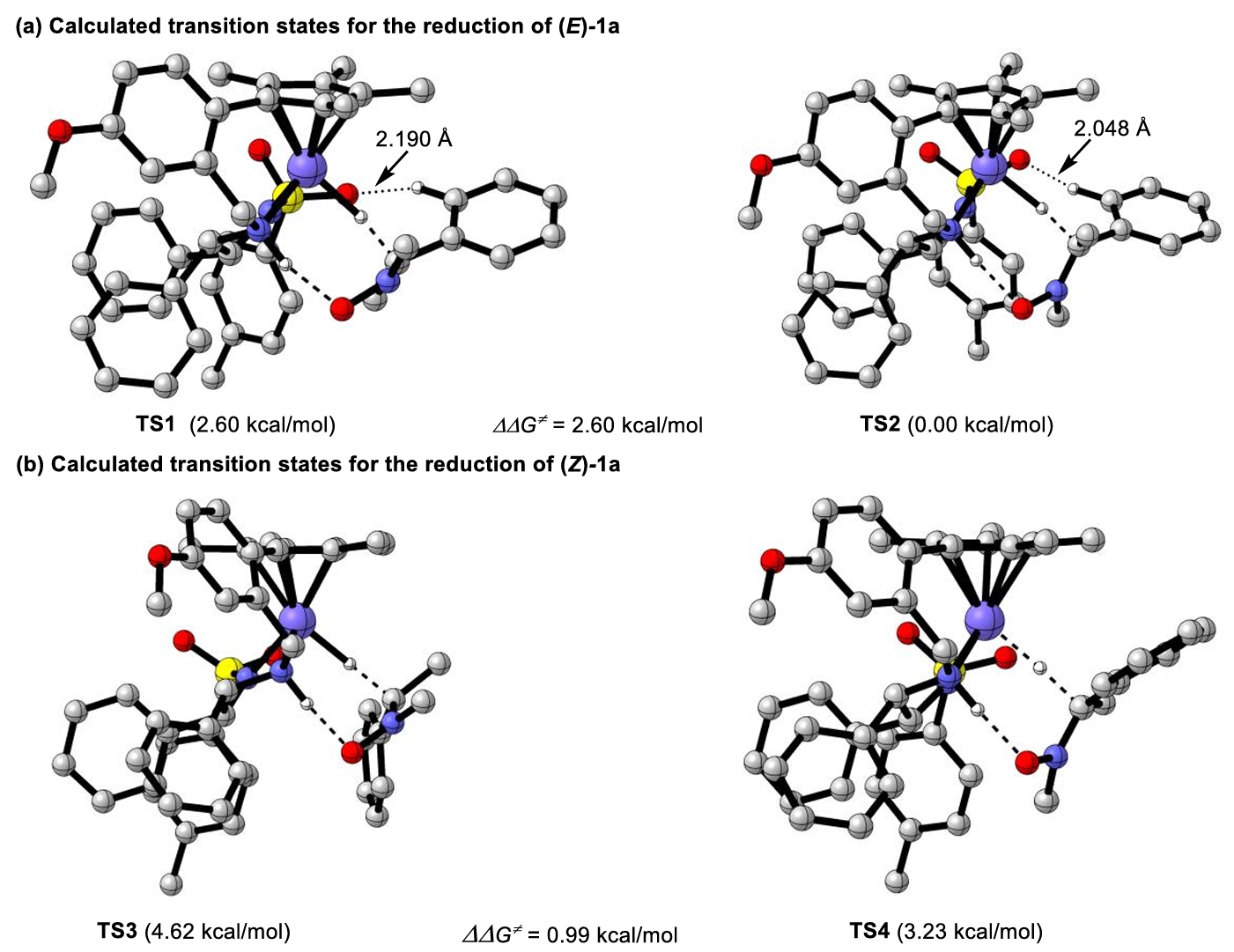
Fig. 3 Calculated transition states for the reduction of (E)-1a and (Z)-1a. The hydrogen atoms were omitted for clarity.
总结
作者开发了一种温和条件下的对1.3-偶极硝酮化合物的高效还原方法,具有令人满意的活性的对映选择性。极大地推动了这一将近二十年没有突破的领域的研究。克级规模试验和产物衍生试验证明了该方法在规模化生产和药物合成等领域的巨大潜力。最后的理论计算和机理实验进一步探讨了这一反应的对映选择性的来源。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.
















No comments yet.