作者:杉杉
导读:
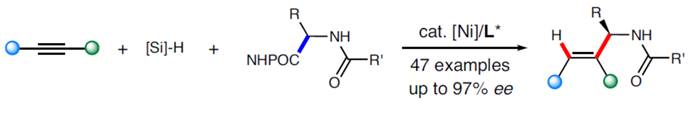
近日,中国科学技术大学王细胜团队在Nat. Commun.中发表题为「Regio‐ and enantioselective nickel-alkyl catalyzed hydroalkylation of alkynes」论文,报道一种全新的镍催化炔烃的区域与对映选择性氢烷基化反应,进而成功完成一系列手性烯丙基胺分子的构建,具有广泛的官能团耐受性、优异的区域与对映选择性等优势。初步的机理研究表明,氨基烷基自由基物种可以被金属捕获并生成烷基镍,其中迁移插入是在金属氢化物插入中逆转区域选择性的关键。
Regio‐ and enantioselective nickel-alkyl catalyzed hydroalkylation of alkynes
Q. Gao, W. Xu, X. Nie, K. Bian, H. Yuan, W. Zhang, B. Wu, X. Wang*.
Nat. Commun. 2024, 15, 6556. doi: 10.1038/s41467-024-50947-0.
正文:
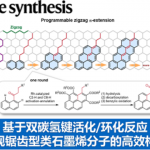
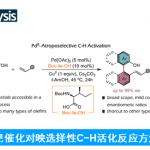
在过去的几年里,镍催化烯烃的氢烷基化已成为构建具有合成价值的功能分子的通用合成策略。然而,采用一种常见原料进行的区域与对映选择性氢/官能团化反应,目前却较少有相关的研究报道[1]。同时,对于Co-H-催化的氢硅化反应、Cu-H-催化的氢烯丙基化反应与Ni-H-催化的氢膦化反应[2]的报道很少,其中区域选择性都是通过金属氢化物插入三键来确定的。或者,如果用一种金属烷基配合物代替,它们向炔烃的迁移插入可以通过炔烃取代基与进入的金属烷基配合物之间的空间需求来控制,这可能会导致相反的区域选择性(Fig. 1a)。在此,王细胜团队设计了一种内炔烃的区域与对映选择性氢烷基化反应,涉及镍-烷基的插入过程(Fig. 1b),从而合成了一系列具有价值的手性烯丙基胺,其广泛存在于各类生物活性分子中(Fig. 1c)。此外,在过去的几十年里,诸多研究团队利用不对称催化策略成功已经设计出多种构建手性烯丙基胺分子的合成转化策略[3],但存在底物范围有限以及官能团兼容性差等问题(Fig. 1d)。这里,中国科学技术大学王细胜团队报道一种全新的镍催化炔烃的区域与对映选择性氢烷基化反应,进而成功完成一系列手性烯丙基胺分子的构建,具有温和的反应条件、广泛的官能团耐受性、优异的区域与对映选择性等优势(Fig. 1e)。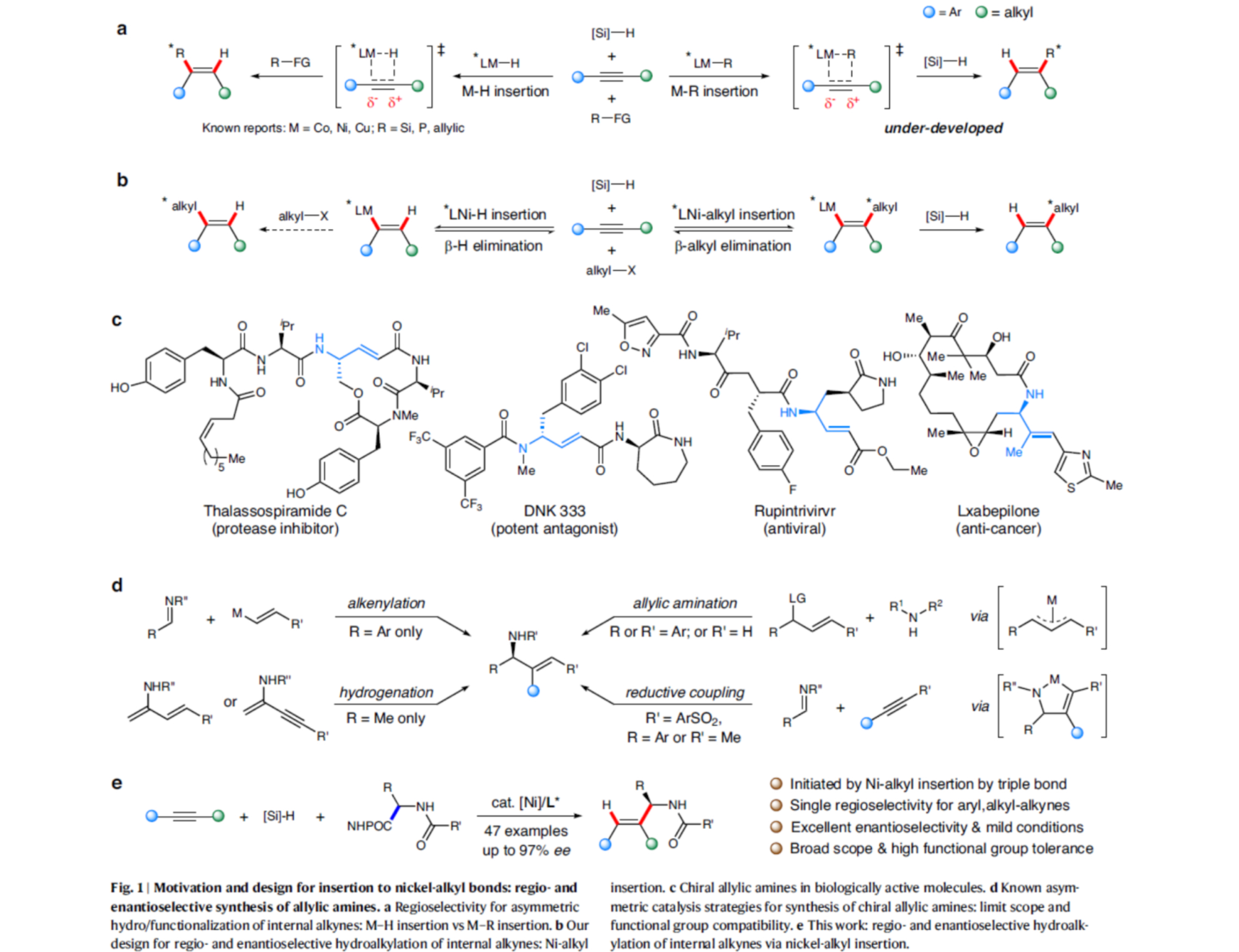
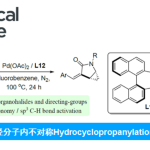
首先,作者采用α-氨基酸衍生的NHPI酯1a与1-苯基丙炔2a作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用NiCl2•DME作为催化剂,L6作为手性配体,Ca(OAc)2作为碱,(MeO)3SiH作为氢源,在NMP/THF (比例为2/1)混合反应溶剂中,反应温度为0 oC,最终以71%收率的烯丙基胺产物3 (97% ee)。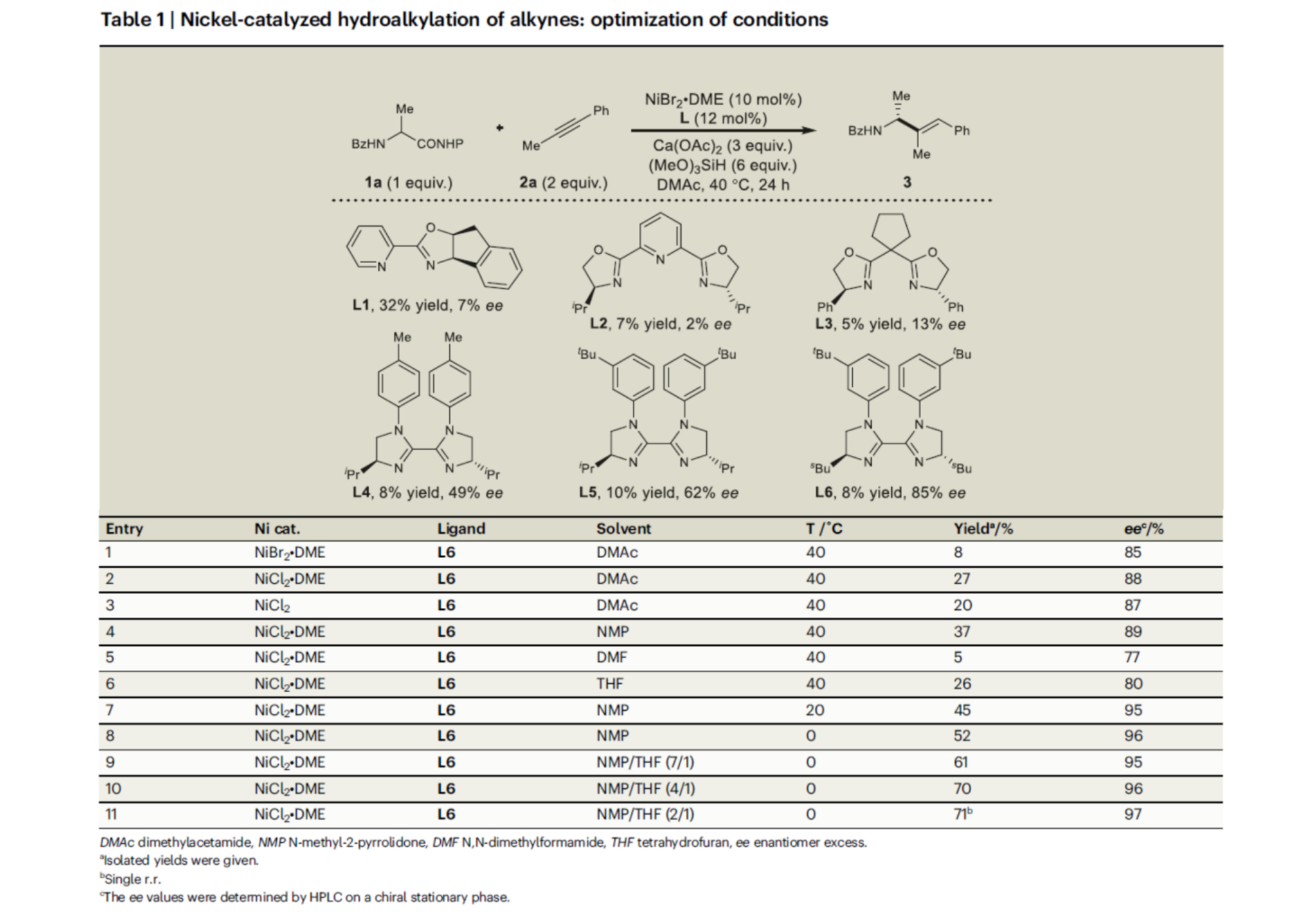 在上述的最佳反应条件下,作者对底物的应用范围进行深入研究(Fig. 2)。首先,一系列芳基烷基炔烃,均可顺利进行反应,获得相应的产物3–21,收率为30-72%,ee为87-97%。同时,对称的二烷基炔烃,也能够进行反应,但反应效率偏低,获得相应的产物22–25,收率为31-40%,ee为93-95%。对于非对称的二烷基炔烃,反应的区域选择性受到影响,如产物26(收率为35%,r.r.为4:1,ee 为96%)与27(收率为25%,r.r.为10:1,ee 为97%)。其次,各种不同的α-氨基酸衍生的NHP酯,均可顺利进行反应,获得相应的产物28–37,收率为37-68%,ee为87-96%。α-氨基酸衍生物的不同N-保护基团,如萘基、噻吩与叔丁基,均与体系兼容,获得相应的产物38–40,收率为30-67%,ee为83-96%。然而,将α-氨基酸衍生物的N-保护基团改为NHP时,反应的对映选择性大幅降低,可以57%的收率得到产物41,ee仅为49%。此外,该策略还可用于一些生物活性分子的后期衍生化实验,如(S)-氟比洛芬、(S)-萘普生、酮洛芬、(S)-布洛芬、伊索克酸、非诺贝特酸、脱氢胆酸与维生素E,可以优异的区域与对映体选择性获得相应的产物42–49,收率为45-75%。
在上述的最佳反应条件下,作者对底物的应用范围进行深入研究(Fig. 2)。首先,一系列芳基烷基炔烃,均可顺利进行反应,获得相应的产物3–21,收率为30-72%,ee为87-97%。同时,对称的二烷基炔烃,也能够进行反应,但反应效率偏低,获得相应的产物22–25,收率为31-40%,ee为93-95%。对于非对称的二烷基炔烃,反应的区域选择性受到影响,如产物26(收率为35%,r.r.为4:1,ee 为96%)与27(收率为25%,r.r.为10:1,ee 为97%)。其次,各种不同的α-氨基酸衍生的NHP酯,均可顺利进行反应,获得相应的产物28–37,收率为37-68%,ee为87-96%。α-氨基酸衍生物的不同N-保护基团,如萘基、噻吩与叔丁基,均与体系兼容,获得相应的产物38–40,收率为30-67%,ee为83-96%。然而,将α-氨基酸衍生物的N-保护基团改为NHP时,反应的对映选择性大幅降低,可以57%的收率得到产物41,ee仅为49%。此外,该策略还可用于一些生物活性分子的后期衍生化实验,如(S)-氟比洛芬、(S)-萘普生、酮洛芬、(S)-布洛芬、伊索克酸、非诺贝特酸、脱氢胆酸与维生素E,可以优异的区域与对映体选择性获得相应的产物42–49,收率为45-75%。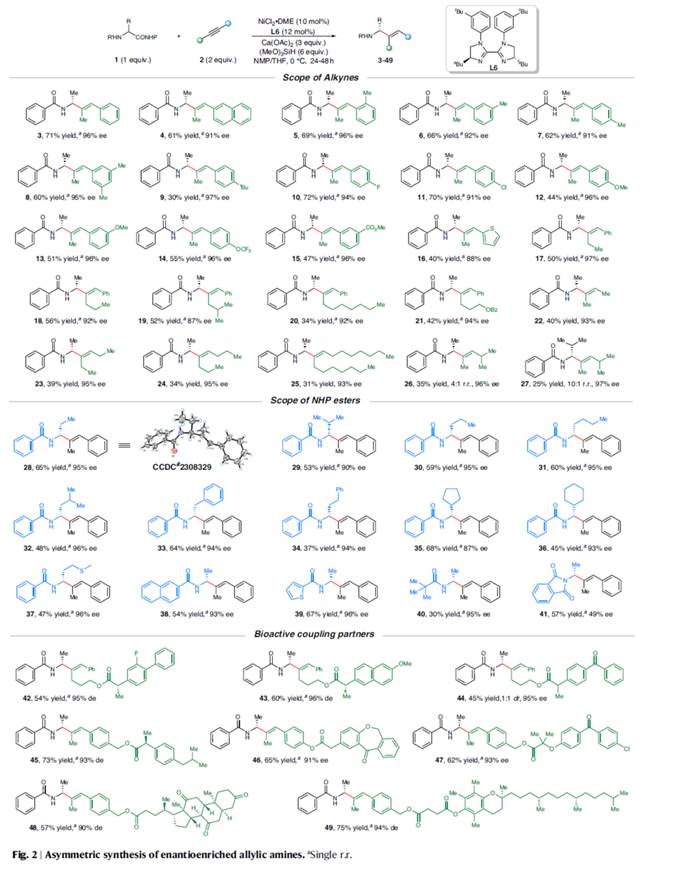 紧接着,作者对反应的实用性进行了研究 (Fig. 3)。首先,1a与2a的放大规模实验,同样可以66%的收率得到产物3,ee为96% (Fig. 3a)。其次,化合物3可进行多种衍生化实验(Fig. 3b)。化合物3可以很容易地转化为手性氨基酮50,收率为75%,ee为96%。手性氨基酮50通过进一步的还原,可有效地转化为手性氨基醇51,收率为85%,ee为97%。化合物3通过环氧化反应,可以71%的收率得到环氧化物52,ee为98%。化合物3通过脱保护与再保护后,可将保护基团进行替换,获得相应的化合物54,收率为80%,ee为96%。
紧接着,作者对反应的实用性进行了研究 (Fig. 3)。首先,1a与2a的放大规模实验,同样可以66%的收率得到产物3,ee为96% (Fig. 3a)。其次,化合物3可进行多种衍生化实验(Fig. 3b)。化合物3可以很容易地转化为手性氨基酮50,收率为75%,ee为96%。手性氨基酮50通过进一步的还原,可有效地转化为手性氨基醇51,收率为85%,ee为97%。化合物3通过环氧化反应,可以71%的收率得到环氧化物52,ee为98%。化合物3通过脱保护与再保护后,可将保护基团进行替换,获得相应的化合物54,收率为80%,ee为96%。
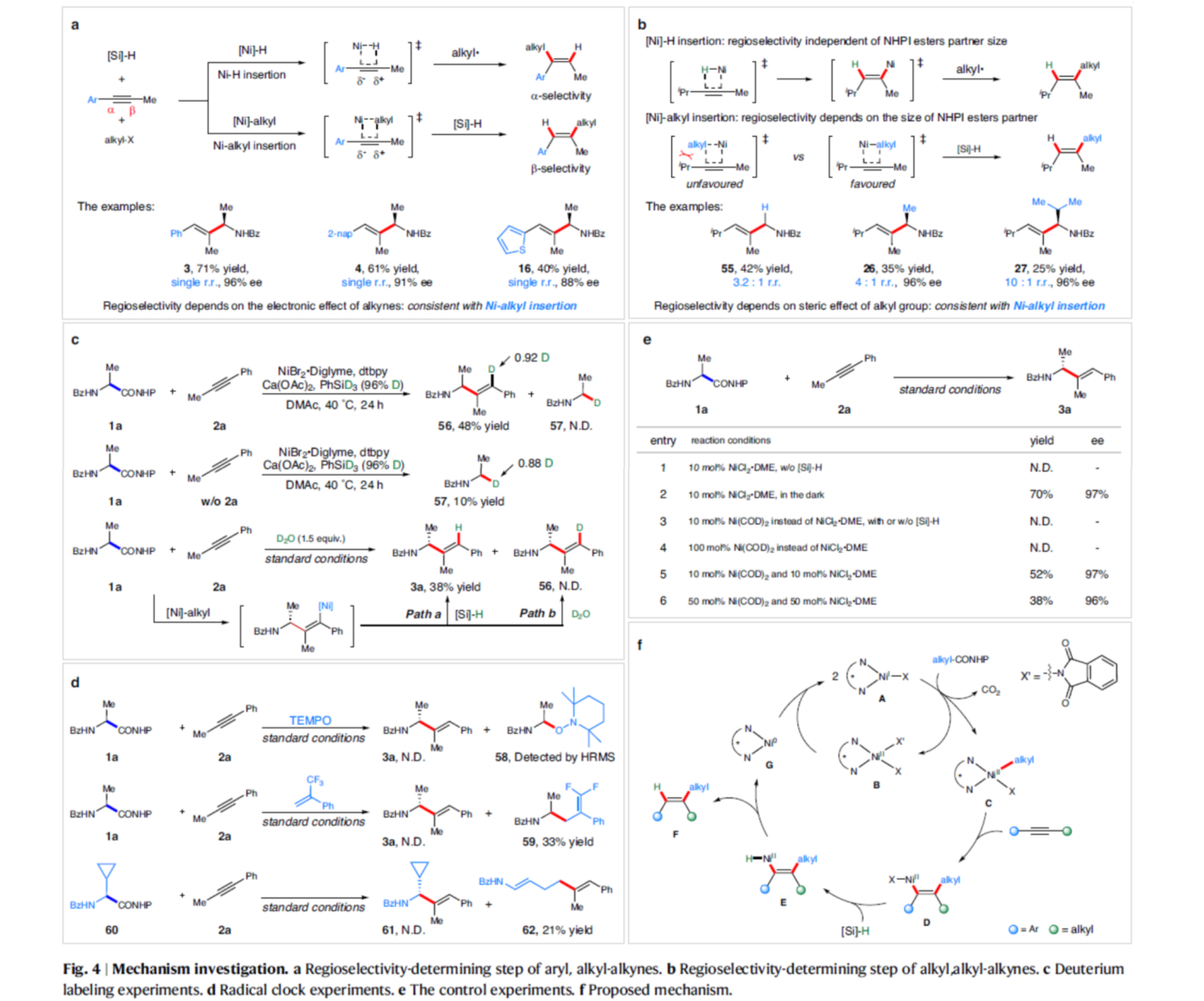
接下来,作者对上述区域与对映选择性氢烷基化过程的反应机理进行进一步研究 (Fig. 4)。芳基/烷基炔烃的区域选择性确定步骤研究发现,其区域选择性取决于炔烃的电子效应 (Fig. 4a)。而在烷基/烷基炔烃的区域选择性确定步骤研究发现,其区域选择性取决于烷基的空间效应(Fig. 4b)。氘代实验结果表明,氢烷基化反应中,氢化物来源于氢硅烷,原位生成的镍-烯基配合物可能与硅烷中的氢化物进行简单的配体交换,而不是用水质子化(Fig. 4c)。自由基钟实验结果表明,反应形成了α-氨基烷基自由基的中间体(Fig. 4d)。对照实验结果表明,光诱导烷基自由基过程不是反应所必须的。同时,金属NiI配合物可以通过Ni0与NiII催化剂的混合物引发反应,但单独添加Ni0催化剂时则没有反应性(Fig. 4e)。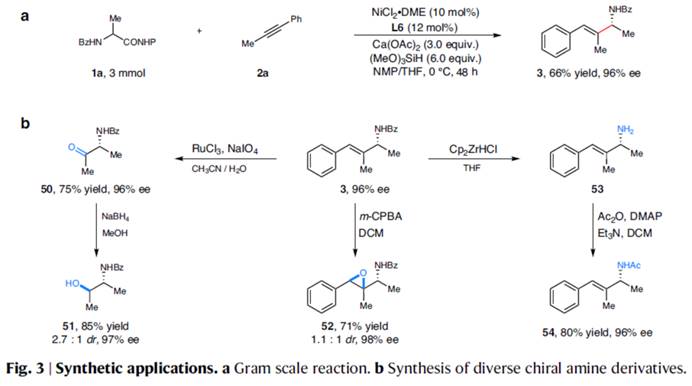
基于上述的实验研究以及前期相关的文献报道[4],作者提出如下合理的反应机理 (Fig. 4f)。首先,NiIX(A)作为催化循环的初始催化剂。在反应条件下,NiIX(A)与NHPI酯反应形成NiIIXX'(B)与NiII(烷基)X中间体(C)。在镍-烷基中间体迁移插入炔烃底物后,NiII(烯基)X中间体(D)将与硅烷进行配体交换,形成Ni-H配合物NiII(烯基)H(E)。最后,通过还原消除,可生成偶联产物(F)与Ni0配合物(G),其与NiIIXX’配合物(B)反应生成NiIX(A),进入下一个催化循环。
总结:
中国科学技术大学王细胜团队报道一种全新的镍催化炔烃的区域与对映选择性氢烷基化反应,进而成功完成一系列手性烯丙基胺分子的构建,具有温和的反应条件、广泛的官能团耐受性、优异的区域与对映选择性等优势。这种不寻常的区域选择性与对映选择性加氢烷基化反应,由闭壳镍-烷基而不是镍-氢迁移插入引发,将为获得与传统镍氢催化不同的区域选择性控制提供一种补充策略。
参考文献:
- [1] C. W. Cheung, F. E. Zhurkin, X. L. Hu, J. Am. Chem. Soc. 2015, 137, 4932. doi:10.1021/jacs.5b01784.
- [2] X. Liu, X. Han, Y. Wu, Y. Sun, L. Gao, Z. Huang, Q. Zhang, J. Am. Chem. Soc. 2021, 143, 11309. doi:10.1021/jacs.1c05649.
- [3] X. Yang, V. Dong, J. Am. Chem. Soc. 2017, 139, 1774. doi: 10.1021/jacs.6b12307.
- [4] N. A. Till, R. T. Smith, D.W. C. MacMillan, J. Am. Chem. Soc. 2018, 140, 5701. doi:10.1021/jacs.8b02834.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.


















No comments yet.