本文作者:海猫
导言
2020年的诺贝尔化学奖颁发给了第三代基因编辑技术-CRISPR/Cas9的发现者:Jennifer A.Doudna和Emmanulle Charpentier。作为一个2012年才初次见刊的新兴技术,它何以有如此大的影响力和魔力呢?它的原理和历史是什么?它又有着怎样的应用和未来呢?在本篇文章中,你将能看到该技术的详细介绍与展望。
正文
随着2020年诺贝尔化学奖的公布,“基因编辑”这个词又一次的在各个社交媒体上刷屏了。而对于大部分人来说,这个词并不算陌生。2018年11月,来自南方科技大学的一名副教授贺建奎对婴儿进行基因编辑而在网络上引起了轩然大波,从而激起了很多人对这项技术本身的好奇:基因编辑的原理是什么?它是潘多拉魔盒吗?它在什么规范内使用是正当的,为人类有益的?
诺贝尔化学奖得主:Jennifer A.Doudna和Emmanuelle Charpentier的合影
基因编辑,是一种可以瞄准某个特定基因,以高准确率来破坏或改变目标DNA的技术。从某种意义上来说,它是一项可以进行品种改良的技术。从远古时期开始,人类就在有意识或无意识的进行品种改良,诸如驯化动植物以强化它们对人类有利的特征。这一改良主要是通过依靠自然突变与重复交配,在较长的时间内来使动植物发展出更贴近人类需要的性征。为了加快它的速度,研究者们使用化学或者物理辐射等方式人工促进突变。这种方法虽然可以在短时间内产生大量多样的基因突变(图 1),但是本质上还是等待偶然符合预期的突变,再想办法将其重复交配保留,仍需要耗费较长的时间。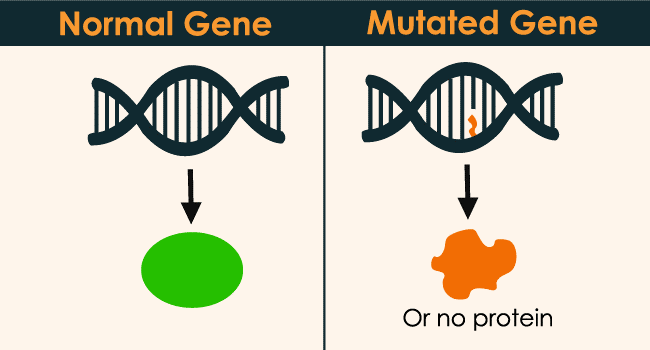
图 1 基因突变示意图
如何更有针对性的去做这样的事情呢?相信“基因重组”这个概念大家一定都不陌生。基因重组(图 2)的定义是“从生物细胞中提取具备有用性状的基因,组合到植物等生物的细胞基因中去,令其获得新的性状。”出现于20世纪70年代的这个技术已经取得了诸多成果,例如在将人胰岛素的基因组合到大肠杆菌中以在大肠杆菌中制造出人胰岛素,或将玫瑰的基因与三色堇生成蓝色素的基因进行融合制造出蓝玫瑰等等。但是基因的融合也是一件较为困难的事情,很有可能无法瞄准插入点导致插到错的地方或者插不进去等等,同样只能重复插入的操作,从中挑选出恰好符合预期的插入结果。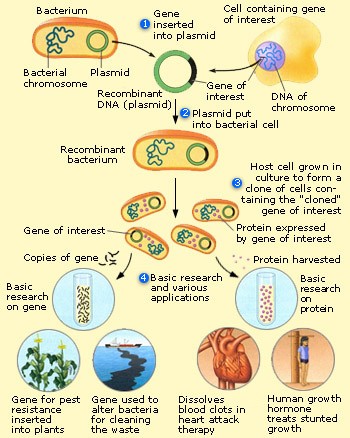
图 2 基因重组技术示意图
而“基因编辑”是一个能让基因重组这一过程精准完成的技术,它可以切开基因所瞄准的位点,使其失去功能;然后将所需的基因插入这个位点;被切断的基因会尝试进行修复,从而与新基因融合到一起,使它成功的插入进去,从而使生物体较快的发展出符合期望的性状。
基因编辑技术的开发要点在于,如何准确的击中想要操作的基因。第一代基因编辑技术使用的是一种核酸酶ZFN(zinc finger nuclease,锌指核酸酶),它由三个锌指蛋白单元(DNA识别域)和一个非特异性核酸内切酶组成。当识别域与目标基因相结合时,该内切酶就能将基因切断,从而使目标基因丧失作用。锌指蛋白对碱基的识别以1-3个为一组,对于特定的碱基序列需要选择与其相对应的锌指来进行排列,并且有时候单纯的依靠排序还是难以识别,且具有一定的细胞毒性,等等。于2010年左右出现的第二代基因编辑技术TALEN(transcription activator-like effector nuclease,转录激活因子样效应物核酸酶)技术则实现了更大的突破。TALEN技术利用了一种植物病原菌黄单胞菌自然分泌的蛋白TALEs(transcription activator-like effectors,转录激活因子样效应物),它们可以特异性识别某个碱基对,从而可以设计一串TALEs以结合任何一段序列。将一串TALEs与核酸内切酶结合,即可准确的读取基因序列并切断目标位点(图 3 )。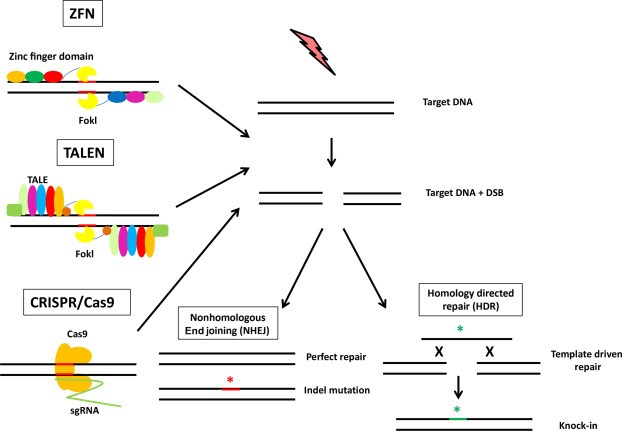
图 3 三代基因编辑技术:ZFN,TALEN与CRISPR/Cas9示意图
前两代基因编辑技术都是基于蛋白质作为向导的,操作过程较为复杂,而第三代基因编辑技术——CRISPR/Cas9则与它们有着根本性的不同。它使用RNA作为向导(图3),操作过程较为简单,因此得以迅速普及。CRISPR(clustered regularly interspaced short palindromic repeat,成簇的规律间隔短回文重复序列)常见于细菌与原核生物体内,是一系列具有独特序列间隔所区分开的短回文重复DNA序列组。它是一种细菌对噬菌体的适应性免疫机制,通过将过往的噬菌体感染的记忆存储为在CRISPR阵列中的间隔DNA序列,这样它们就可以在之后被感染的时候利用这些信息来辨认并摧毁相同的入侵噬菌体。
对CRISPR系统的早期研究聚焦在大肠杆菌和绿脓杆菌的免疫系统上,而2011年于波多黎各举行的一个研讨会上,两位本次诺奖得主的会面则改变了它的命运。来自于默奥大学的Emmanuelle Charpentier希望可以搞清楚化脓性链球菌中II型CRISPR系统是如何剪掉病毒DNA的,并希望与来自加州大学伯克利分校的Jennifer Doudna共同合作,探究Cas9蛋白。经过了他们的数次实验,一个具有Cas9蛋白、CRISPR RNA与tracrRNA的体系成功的将目标DNA切开了。而这体系并不会像消灭噬菌体一样来摧毁动植物等生物,因为细胞能够通过一套复杂的DNA修复系统来对损毁的DNA进行修复。为了降低系统的复杂度,研究人员使用头尾相接的办法将CRISPR RNA与tracrRNA组合成一个引导RNA,然后他们证明了这个单一的引导RNA分子仍然能够引导Cas9去切割相匹配的DNA序列。来自全球各地的研究者开始了对CRISPR技术的探索与拓展,其中就有一位来自麻省理工学院的华人科学家张锋博士。张锋研究组确认了CRISPR/Cas9亦可应用于人类和动物细胞,并对其进行了进一步改良,充分展示了它在技术层面的巨大潜力。距离CRISPR/Cas9技术初次见刊的2012年(图 4),到它获此殊荣的2020年,仅仅过去了8年,可见它真的是一个划时代的技术。
图 4 2012年初次报道在Science上的CRISPR/Cas9文献封面
诚然,基因编辑可以在很多的领域造福人类。例如,基因组编辑可以对人类解决食物来源问题提供一个新的选项,通过快捷的对动物进行品种改良,可以提高全球食物的产出;或者通过基因编辑令藻类制造淀粉的功能失效,从而增加其产生油脂的量,成为一种新的生物能源,等等。对一些疾病,诸如HIV、某些遗传病等的治疗,研究者们也都在不断的取得成果。然而作为一项简单的工具,它也存在被滥用的风险。例如有研究报道,通过对高致病性禽流感病毒“H5N1”的某个基因位点进行修改,可导致其获得感染哺乳动物的能力,从而可以作为一种生物武器。即使基因编辑是精准的进行改变,不会像转基因作物一样留下痕迹,如何将基因编辑技术普及给大众,让他们接受基因编辑后的动植物;或者如何有效的进行监管,使研究者在伦理允许的范围内进行研究,这些问题仍需要被有力的解决,并与大众进行共享。
至于对基因编辑婴儿类似的事情是否会成为未来的担心,我想有一句话可以很好的阐述这一点:“基因是来自人类祖先的宝贵遗产,比起因为在当今社会的生活有所不便就拒绝将其遗传给下一代,我们更应该做的,是创造出能坦然接受这些不便的社会。”希望这个神奇的“基因魔剪”技术可以在之后为人类谋更多的福祉,创造出更多生命的可能性——在这项技术创造的海洋中,属于广大研究者的探险已经势如破竹了。
参考文献
[1] Jinek, M.; Chylinski, K.; Fonfara, I.; Hauer, M.; Doudna, J. A.; Charpentier, E., A Programmable Dual-RNA–Guided DNA Endonuclease in Adaptive Bacterial Immunity. Science 2012, 337 (6096), 816 DOI: 10.1126/science.1225829.[2] 日本NHK“基因组编辑”采访组. 基因魔剪——改造生命的新技术[M]. 浙江大学出版社, 2017.
[3] 利民•邓. 30分钟读懂《造物解密》[M]. 浙江出版集团数字传媒有限公司, 2018.




















No comments yet.