本文投稿作者:孙苏赟
概要
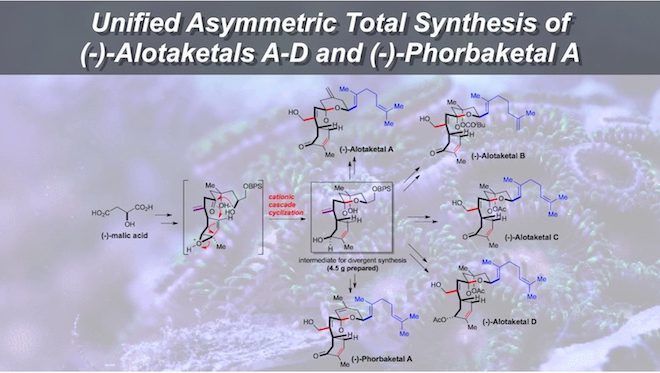
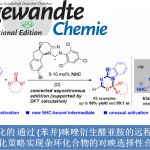
(-)-AlotaketalsA–D和(-)-PhorbaketalA是一系列具有螺环结构的二半倍萜化合物,因具有一些特殊的生物活性,其合成被广泛关注。
来自香港科技大学(HKUST)的童荣标报道了这一类化合物中(-)-AlotaketalsA–D和(-)-PhorbaketalA的全合成工作。
Unified Asymmetric Total Syntheses of (−)-Alotaketals A–D and (−)-Phorbaketal A.
Hang Cheng, Zhihong Zhang, Hongliang Yao, Wei Zhang, Jingxun Yu, Rongbiao Tong
Angew. Chem. Int. Ed. 2017, 56, 9096–9100, doi:10.1002/anie.201704628),
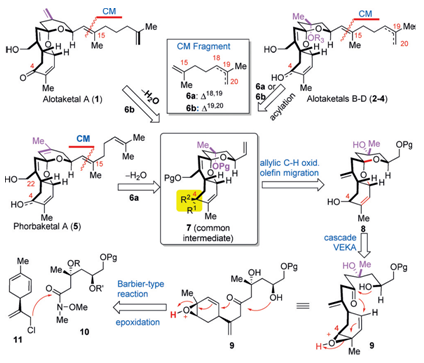
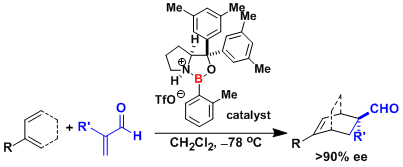
合成中的关键步骤有:a.利用串联反应构筑三环螺环中间体化合物;b.烯丙基氧化;c.利用烯烃复分解反应(CM)获得具有不同侧基的化合物
FIGURE1
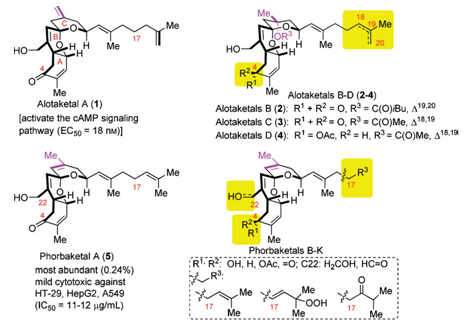
内容介绍
在此前,AlotaketalA已经有了相关的合成工作报道(Figure2),而他们都是先合成A和B环之后再合成C环的。[1-3]
FIGURE2
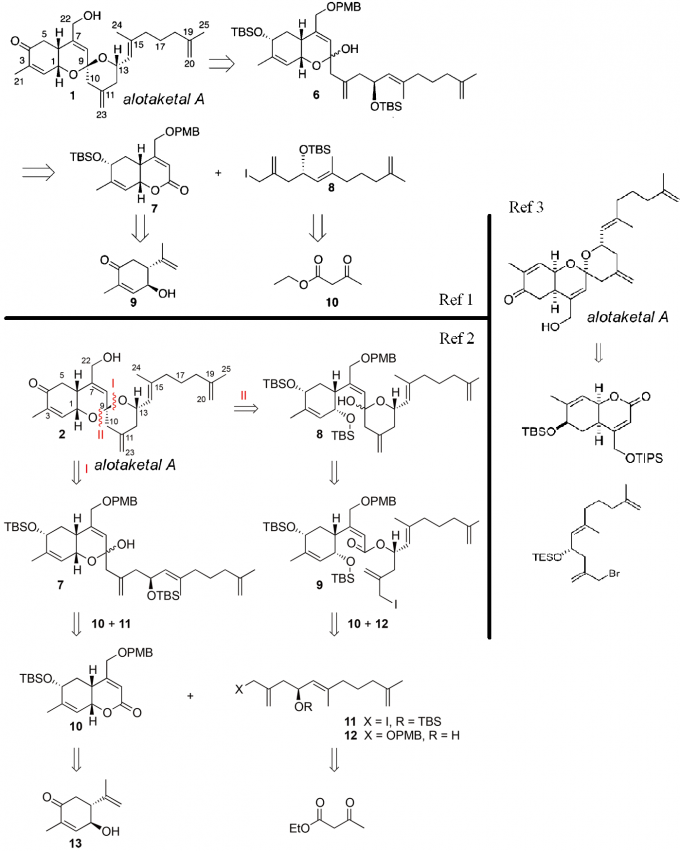
先来看逆合成分析(Scheme1):
Scheme1逆合成分析
先通过烯烃交叉复分解反应将五个目标化合物不同的侧链切断,1和5需要再脱去一个水分子,这样五个化合物就切断成了一个线性二烯烃6a/6b和一个可以进行发散性合成的共同的重要中间体7,再利用烯丙基氧化发生双键迁移转化成8;之后的8很适合进行阳离子串联环化反应得到,因此在这里逆合成分析到环化前体乙烯基环氧-δ-酮醇(vinylepoxyδ–keoalcohols,VEKAs)9,9通过10和11的Grignard反应得到。由此可以看出合成的两大难点:
- VEKA进行串联环化反应的立体选择性和化学选择性[4];
- 在复杂的三环化合物中实现选择性的烯丙基C-H氧化
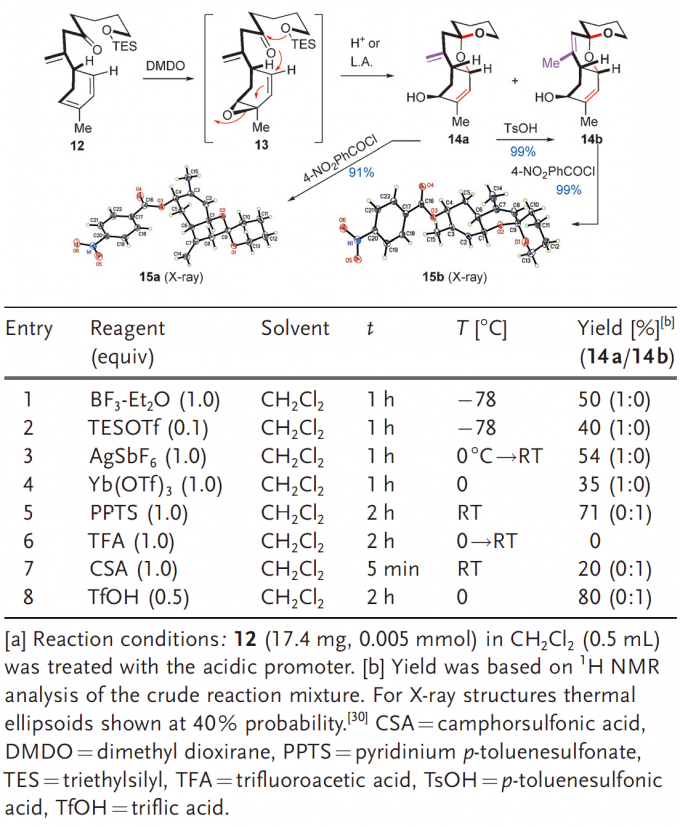
Table1VEKA串联环化反应的条件筛选
首先是利用模型分析对于VEKA进行串联环化反应反应条件的筛选,底物12可被DMDO环氧化成不稳定的中间体13(核磁可以观测到),13进而用Lewis酸(Lewisacid,LA)进行处理即可发生LA诱导下的阳离子串联环化反应。在众多测试的LA中,TfOH的效果最佳,可以进行100μg规模的反应。其中,BF3.EtO2,TESOTf,AgSbF6,Yb(OTf)3四种LA只会得到三环化合物14a,中等产率,而PPTS,TFA,CSA和TfOH四种Brønsted酸会得到14a/14b两种产物,而且产率更高。当用pTSA处理时,两种异构体的含量是定量的。另外14a/14b的的结构式分别是由他们的苯甲酰衍生物Xray晶体衍射分析得到的。
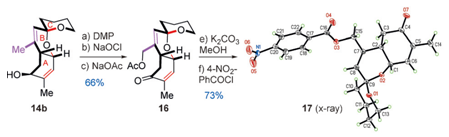
Scheme2烯丙基C-H氧化反应的模型分析及其产物的Xray晶体衍射分析
第二个困难的问题便是选择性的烯丙基C-H氧化了。在上一步得到14b之后,将其用于这一步的研究,多次实验发现DMP可以使得发生目标反应,原因可能是A和B环上因为取代基的原因形成电子密度的差异从而实现了化学选择性而发生了选择性的氧化反应。14b和NaOAc发生取代生成16,其立体构型由它的苯甲酰衍生物Xray晶体衍射分析得到。
在克服了以上两个潜在的合成的难点之后,接下来就是对关键中间体7的合成了。
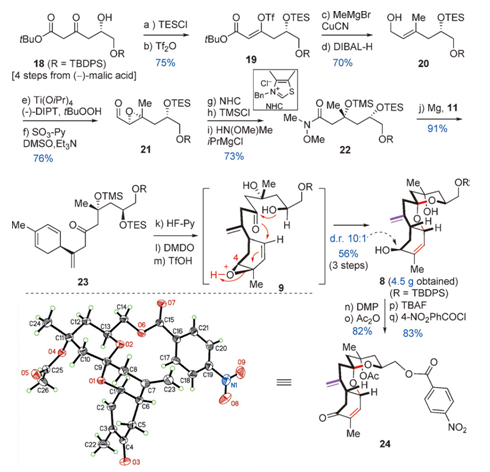
Scheme38的合成
正如之前的逆合成分析所述,将18(由(-)-苹果酸经过四步合成)用TESCl和Tf2O分别进行保护基化和烯醇化得到19;之后用Grignard试剂搭配CuCN进行甲基化,再用DIBAL-H还原酯基生成20,用Ti(OiPr)4和tBuOOH进行Parikh-Doering环氧化反应,再进行Swern氧化得到醛类环氧化合物21,21进行氧化还原酯化反应、上TMS保护基和酰胺化反应[5],其中NHC的作用和DMAP催化的酯化反应的作用类似;这样就得到了22,将22和11在Mg生成Grignard试剂的的条件下生成了可以进行串联环化反应的前体23,那么再用HF-pyr脱去TMS,DMDO氧化和TfOH作为LA进行VEKA的阳离子串联环化反应得到中间体8,但是8是的C4的非对映异构体的混合物,两者比值为10:1,这个反应的规模达到了惊人的4.5g!! 同样地,8的结构是由它的苯甲酰衍生物进行Xray晶体衍射分析得到的。
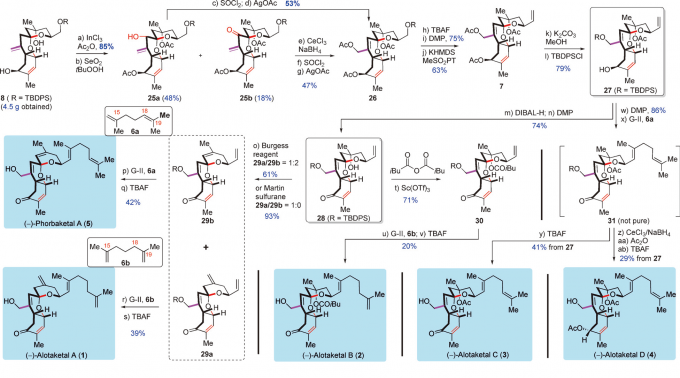
Scheme4发散的合成(-)-AlotaketalsA–D(1-4)和(-)-PhorbaketalA(5)
既然上述得到了4.5g的8,那么接下来就可以进行五个目标化合物的合成啦。因为传统的酯化反应的条反应的产率相对较低,因此采用了InCl3催化的酯化反应(产率85%),再用Reily氧化生成烯丙基醇化合物25a(48%),但是此时还会存在18%的过度氧化的产物25b,但是25a/25b分别在SOCl2/AgOAc[6]和CeCl3,NaBH4/SOCl2/AgOAc的条件下可以得到同一个产物26。其中关于烯丙基的氧化反应,其他的条件例如Kharasch-Sosnovsky反应,NaOCl/CeCl3等都会使得8发生分解。将8用TBAF脱去BPS保护基,DMP氧化醇为醛,在用Julia-Kocienski反应生成端烯7,再除去乙酸酯上DPS保护基,即是可以进行发散性合成的重要中间体27了。
先进行的是1和5的合成。C环上的季醋酸酯在DIBAL-H的处理下被还原成了醇28,再用Burgess试剂对28进行脱水就形成了两个化合物29a/29b的混合物,但是用DMP只能得到29a一个产物。用GrubbsII催化剂/二烯29a/6a和29b/6b进行烯烃复分解反应即可得分别得到(-)-PhorbaketalA(5)和(-)-AlotaketalA(1)了。
接下来是2的合成。在Sc(OTf)3的催化下28和(iBuCO)2O发生酯化反应得到30,30后续加上侧链6b就完成了(-)-AlotaketalB(2)的合成了。
相反地,如果C环上的季醋酸酯不被还原而直接用DMP氧化再进行烯烃复分解反应连接上侧基6a,那么可以得到31,未提纯的31用TBAF脱去保护基就得到了(-)-AlotaketalC(3);若将31用CeCl3,NaBH4/Ac2O/TBAF处理就可以得到在C4位酰基化的(-)-AlotaketalD(4)了
后记
至此,(-)-AlotaketalsA–D和(-)-PhorbaketalA的全合成就完成了。这篇文章是在小编日常逛ACIE的时候发现的,自认为之前看了不少全合成的文章,觉得这篇文章可能是一篇水文,但是之后下载了supportinginformation仔细研读之后发现,supportinginformation中核磁的日期最早始于2014年春季,那是小编我在上大一,作者当时就开始了这五个化合物的合成工作。惊讶之余,也认识到了自己的肤浅,感叹全合成工作一直是十分艰难如履薄冰的。
参考文献
- J. Am. Chem. Soc., 2012, 134 (21), 8806–8809, DOI:10.1021/ja303529z
- Org. Biomol. Chem., 2013, 11, 3212-3222, DOI:10.1039/c3ob40120k
- Org. Lett., 2012, 14 (21), 5492–5495, DOI:10.1021/ol302570k
- Chem. Rev., 2014, 114 (16), pp 8037–8128, DOI: 10.1021/cr400709j
- J. Am. Chem. Soc. 2004, 126, 8126 –8127, DOI: 10.1021/ja047407e
- J. Am. Chem. Soc. 1997, 119, 12976–12977, DOI: 10.1021/ja972279y
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!















No comments yet.