本文作者:杉杉
导读
近日,中国科学技术大学王川课题组在ACS Catal.上发表论文,报道了一种通过交叉亲电偶联的策略,可合成一系列多取代丙二烯衍生物。其中,使用镍为催化剂,可实现炔丙基碳酸酯(propargyl carbonates)和有机碘化物之间的还原性交叉偶联反应,从而获得三/四取代的丙二烯衍生物,且无需使用预生成的有机金属化合物。此外,炔丙基碳酸酯也可作为镍催化芳基碘系(aryl-iodide-tethered)未活化烯烃不对称还原芳基-烯基化反应中的烯丙基化试剂,并以高度对映选择性的方式合成各种手性苯稠合环状化合物,且具有四级丙二烯基取代的立体生成中心。
Synthesis of Multisubstituted Allenes via Nickel-Catalyzed Cross-Electrophile Coupling
Youxiang Jin, Hao Wen, Feiyan Yang, Decai Ding, and Chuan Wang* ACS Catal.2021, 11, 13355.
正文
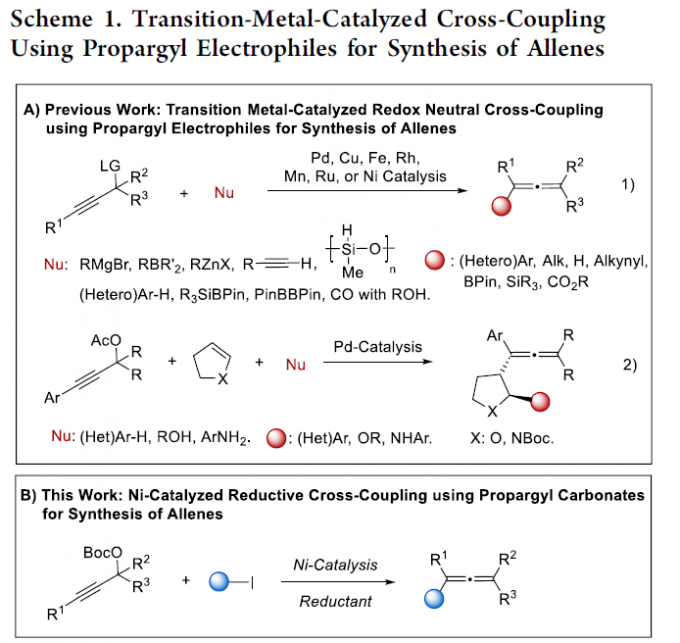
丙二烯化合物是一类重要的有机化合物,不仅存在于生物活性分子中,还作为有机合成中的通用结构单元。在合成丙二烯化合物的众多策略中,过渡金属催化炔丙基亲电试剂与各种亲核试剂的交叉偶联反应,已成为一种有效的方法[1]。迄今为止,成功的亲核偶联参与物包括Grignard试剂、有机锌、有机硼、末端炔烃、(杂)芳烃、氢硅烷、硅基硼酸酯、二硼酸酯以及CO与醇或水的组合(Scheme 1A, eq 1)。最近,在钯催化二氢呋喃或吡咯啉与(杂)-芳烃、醇或苯胺作为亲核试剂的三组分烯丙基化反应中,炔丙基乙酸酯被用作亲电烯丙基化试剂[2](Scheme 1A, eq 2)。此外,炔丙基亲电试剂的非催化SN2’反应,也作为合成丙二烯衍生物的一种替代方法[3]。
近年来,镍催化交叉亲电偶联具有高步骤经济性和官能团耐受性等优点,备受有机化学家的关注。例如,有机(伪)卤化物之间的直接交叉偶联[4]、烯烃的双官能团化[5]和开环反应[6]。然而,在交叉亲电偶联反应中使用炔丙基亲电试剂作为烯丙基化试剂仍难以捉摸。
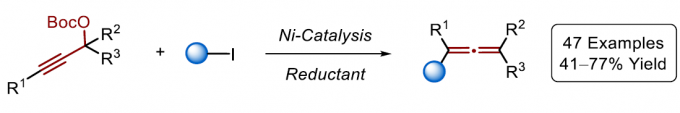
在此,中国科学技术大学王川课题组报道了交叉亲电策略在丙二烯合成中的首次应用,其中在化学计量金属还原剂的协助下,可实现镍催化炔丙基碳酸酯与烷基/芳基碘反应,从而获得多种多取代丙二烯衍生物,同时避免了有机金属化合物的预合成。
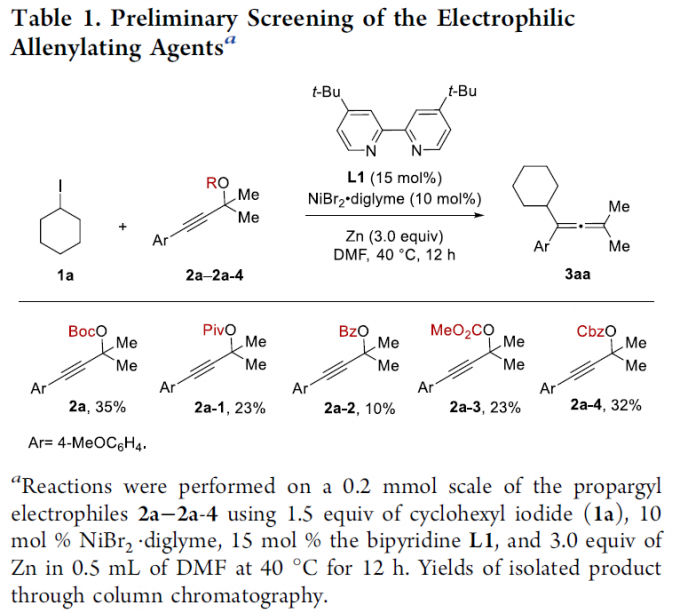
首先,作者采用环己基碘1a与炔丙基酯2作为模型底物,对烯丙基化试剂进行了筛选(Table 1)。确定最佳的反应条件为:以炔丙基酯2a为烯丙基化试剂,采用NiBr2·diglyme作为催化剂,L1作为配体,Zn作为还原剂,在DMF溶剂中,40 oC下进行反应12 h,最终获得35%收率的四取代丙二烯产物3aa。
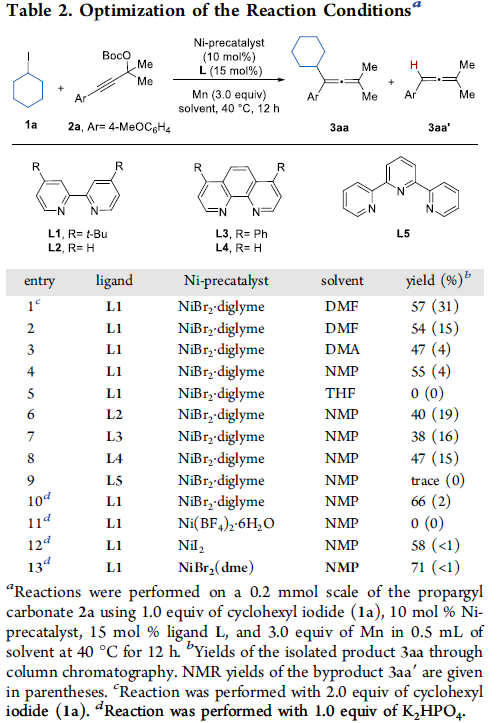
为了进一步提高反应的收率,作者采用环己基碘1a与炔丙基酯2a作为模型底物,对反应条件进行了进一步的优化(Table 2)。确定最佳的反应条件为:采用NiBr2(dme)作为催化剂,L1作为配体,Mn作为还原剂,K2HPO4作为添加剂,在NMP溶剂中,40 oC下进行反应12 h,最终获得71%收率的四取代丙二烯产物3aa。
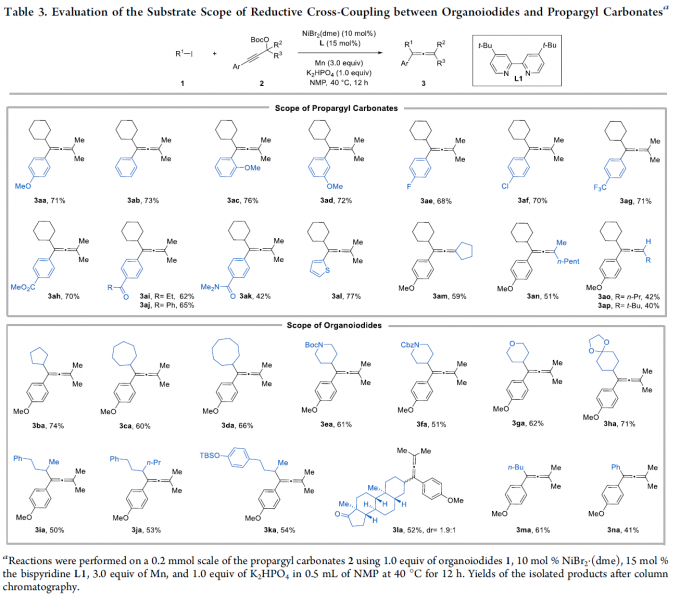
在上述最佳反应条件下,作者对底物应用范围进行考察(Table 3)。研究表明,一系列芳基上带有供电子基与吸电子基取代的炔丙基碳酸酯底物均能较好地与上述反应条件兼容,并获得相应的产物3aa–3ak,收率为42-76%。值得注意的是,对于有机金属敏感的酯(3ah)和酮(3ai和3aj)在该体系中均可相容。同时,含有噻吩基、环戊基取代的炔丙基碳酸酯也是合适的底物,获得产物3al(77%)和3am(51%)。其次,对于不对称取代的三级炔丙基碳酸酯底物2n,也可进行反应,获得51%收率的产物3an。然而,对于二级炔醇衍生物2o和2p,由于体积较小的二级炔丙基碳酸酯更易发生同偶联反应,导致产物3ao和3ap的收率相对较低。此外,作者还对碘代物的范围进行了扩展。一系列环状/非环状仲烷基碘,在标准反应条件下均可顺利反应,获得相应的产物3ba–3ka,收率为50-74%。值得注意的是,类固醇衍生物1l也是合适的底物,以53%的收率获得两种非对映异构体3la,可通过柱层析简单地将其分离。当以正丁基碘底物1m时,以61%的收率获得产物3ma。不幸的是,使用三级烷基卤的反应未能生成所需的丙二烯产物。此外,该策略还适用于苯基碘底物1n,可获得41%收率的产物3na。
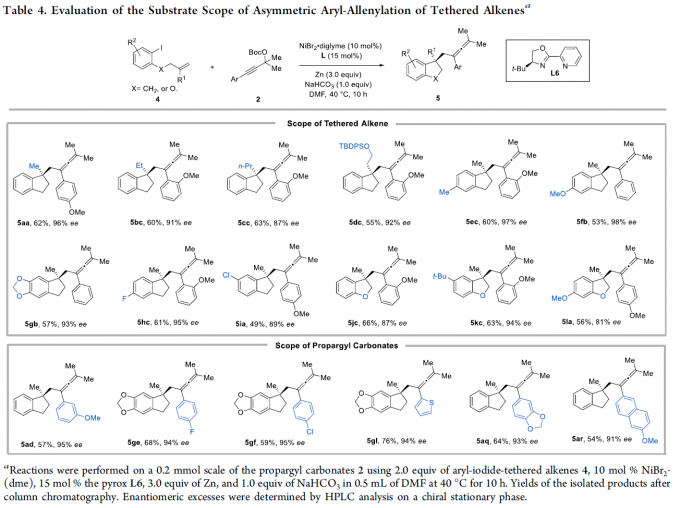
此外,通过对反应条件的再次优化后发现,当采用NiBr2·diglyme作为催化剂,手性L6作为配体,Zn作为还原剂,NaHCO3作为添加剂,在DMF溶剂中,40 oC下进行反应10 h,可实现高度不对称芳基-烯丙基化反应。因此,作者对底物范围进行了考察(Table 4)。研究表明,芳基上具有不同的取代基以及杂芳基取代的烯烃和炔烃底物,均可顺利进行反应,获得相应的手性茚满和二氢苯并呋喃产物5aa–5ar,收率为46-76%,ee为81-98%。
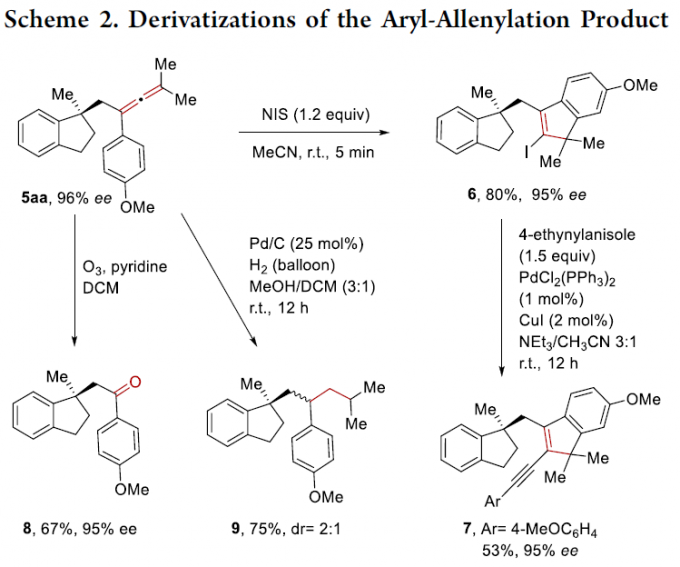
为了进一步研究上述反应的实用性,作者进一步对获得的手性茚满产物进行相应的后期修饰(Scheme 2)。首先,化合物5aa在NIS介导下进行碘化反应,可获得80%收率的2-碘茚化合物6,随后通过钯催化的Sonogashira偶联反应,可获得53%收率的产物7,且ee不受影响。其次,在臭氧条件下,化合物5aa也可转化为酮8,收率为67%,ee不受影响。此外,在Pd/C催化氢化条件下,化合物5aa可转化为非对映体化合物9,收率为75%,dr为2:1。
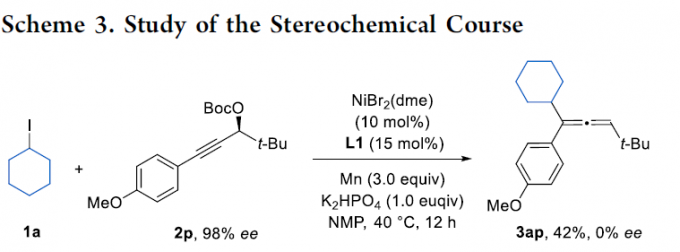
同时,为了深入了解这种镍催化反应的立体化学过程,作者采用对映富集的炔丙基碳酸酯(2p)作为底物 (Scheme 3)。反应结果表明,由于产物3ap以外消旋的形式形成,从而表明在炔丙基碳酸酯与低价镍的氧化加成过程中发生了外消旋化。
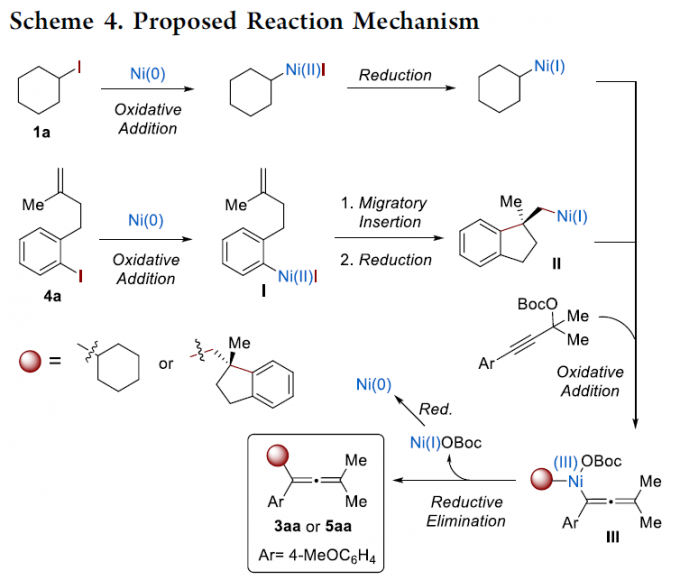
基于上述研究以及前期的文献报道[1-6],作者提出了一种合理的反应机理路径(Scheme 4)。首先,1a与Ni(0)配合物进行氧化加成和还原过程,形成CyNi(I)。4a与Ni(0)配合物进行氧化加成、迁移插入和还原过程,形成Ni(I)中间体II。随后,炔丙基碳酸酯1a与CyNi(I)或Ni(I)中间体II进行二次氧化加成,形成丙二烯基Ni(III)配合物III,经还原消除,即可获得目标产物3aa或5aa。同时,通过锌或锰介导的Ni(I)OBoc还原,可实现Ni(0)配合物的催化循环。
总结
中国科学技术大学王川课题组报道了一种镍催化有机碘化物和炔丙基碳酸酯之间的交叉亲电偶联反应,可合成一系列多取代的丙二烯衍生物,且无需繁琐有机金属预形成的过程。同时,炔丙基碳酸酯也可作为镍催化未活化烯烃不对称还原芳基-烯基化反应中的烯丙基化试剂,并以高度对映选择性的方式合成各种手性茚满和二氢苯并呋喃化合物,且具有四级丙二烯基取代的立体生成中心。
参考文献
[1] (a) N. Krause, A. Hoffmann-Röder, Tetrahedron 2004, 60, 11671. doi: 10.1016/j.tet.2004.09.094(b) S. Ma, Eur. J. Org. Chem. 2004, 2004, 1175. doi: 10.1002/ejoc.200300352
(c) M. Ogasawara, Tetrahedron : Asymmetry 2009, 20, 259. doi: 10.1016/j.tetasy.2008.11.039
[2] (a) S. Teng, Z. Jiao, Y. R. Chi, J. S. Zhou, Angew. Chem. Int. Ed. 2020, 59, 2246. doi: 10.1002/anie.201911961(b) S. Teng, Y. R. Chi, J. S. Zhou, Angew. Chem. Int. Ed. 2021, 60, 4491. doi: 10.1002/anie.202014781
[3] (a) M. Mae, J. A. Hong, B. Xu, G. B. Hammond, Org. Lett. 2006, 8, 479. doi: 10.1021/ol052816g(b) M. Yoshida, Y. Komatsuzaki, M. Ihara, Org. Lett. 2008, 10, 2083. doi: 10.1021/ol800663v
(c) K. Kobayashi, H. Naka, A. E. H. Wheatley, Y. Kondo, Org. Lett. 2008, 10, 3375. doi: 10.1021/ol801249w
[4] (a) D. A. Everson, R. Shrestha, D. J. Weix, J. Am. Chem. Soc. 2010, 132, 920. doi: 10.1021/ja9093956(b) X. Yu, T. Yang, S. Wang, H. Xu, H. Gong, Org. Lett. 2011, 13, 2138. doi: 10.1021/ol200617f
[5] (a) K. Wang, Z. Ding, Z. Zhou, W. Kong, J. Am. Chem. Soc. 2018, 140, 12364. doi: 10.1021/jacs.8b08190(b) Y. Jin, C. Wang, Angew. Chem. Int. Ed. 2019, 58, 6722. doi: 10.1002/anie.201901067
[6] (a) Y. Zhao, D. J. Weix, J. Am. Chem. Soc. 2014, 136, 48. doi: 10.1021/ja410704d(b) Y. Zhao, D. J. Weix, J. Am. Chem. Soc. 2015, 137, 3237. doi: 10.1021/jacs.5b01909
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载



















No comments yet.