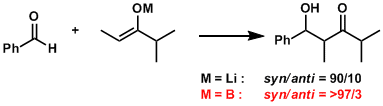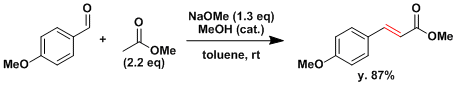- 概要
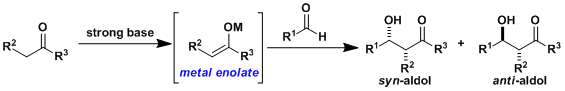
在LDA等强碱下,将doner一侧的羰基化合物的α位完全脱氢、提前制备金属烯醇盐,抑制其自缩合,得到交叉缩合产物的方法。
根据烯醇盐的立体差异性、与立体特异的醛及酮反应,可相应得到syn/anti-羟醛体。
由迁移金属化可以制备Li、Na、Mg、Zn、B、Al、Ti等各种金属烯醇盐、其中只有硅和锡的烯醇盐可以分离精制。特别是在路易斯酸性条件下硅烯醇盐的羟醛加成反应通常称作向山羟醛缩合反应。
在全合成中,该偶联缩合的例子也不少。其他的例子详见文献・Review。
- 基本文献
・Heathcock, C. H. Comprehensive Organic Synthesis 1991, 2, 133.
・Kim, B. M. et al. Comprehensive Organic Synthesis 1991, 2, 239.
・Paterson, I. Comprehensive Organic Synthesis 1991, 2, 301.
・Mahrwald, R. ed. Modern Aldol Reactions Wiley-VCH, 2004
・Review: Palomo, C.; Oiarbide, M.; Garcia, J. M. Chem. Eur. J. 2002, 8, 36. [abstract]
・Review: Palomo, C.; Oiarbide, M.; Garcia, J. M. Chem. Soc. Rev. 2004, 33, 65. DOI:10.1039/b202901d
・Review: Schetter, B.; Mahrwald, R. Angew. Chem. Int. Ed. 2006, 45, 7506. doi:10.1002/anie.200602780
- 反应机理
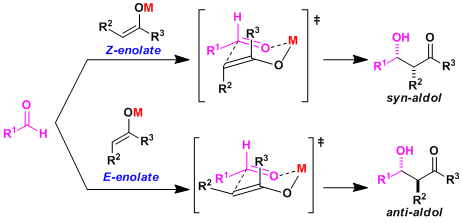
用Zimmerman-Traxler六元环过渡态模型(J. Am. Chem. Soc. 1957, 79, 1920.)能够较好的解释说明底物与产物立体化学见得关系。因为醛的取代基equatorial处在平伏位置的过渡态稳定,有烯醇的立体特异性决定产物的立体化学。也就是说,由Z-烯醇盐得到syn构型羟醛产物、由E-烯醇盐得到anti构型产物。
一般而言,使用M-O键强的金属(硬酸,络合能较大的金属)六元环过渡态的环足够稳固,立体选择性会提高。
加入HMPA等与锂等金属配位能力较强的配位性溶剂、可使金属烯醇盐得到极化,提高反应性能。另一方面,因它不可能采取六元环过渡态,会使选择性反转,就变得依赖于底物。
- 反应实例
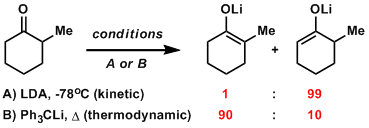
含有取代基的同的烯醇盐制备,位置选择性是常见问题, 通过热力学/速度论的条件控制也能实现高位置选择性。
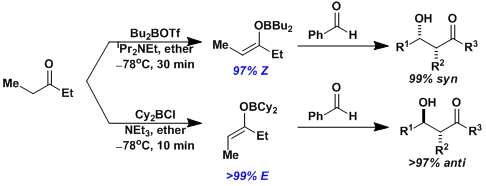
硼的烯醇盐B-O键较短,能够形成稳固的六元环、相比锂的烯醇盐立体选择性会提高。
硼的烯醇盐,通过不同试剂处理可以选择性的得到E/Z式烯醇盐[1]
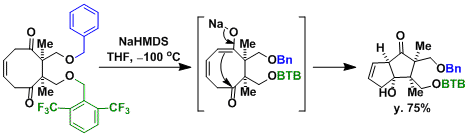
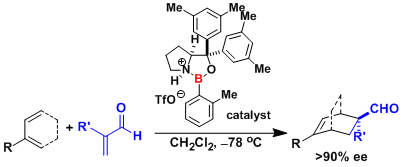
Merrilactone A的合成[2]:非対称分子内羟醛反应的应用。
羰基化合物的如果不能产生烯醇化合物(例如HCHO、ArCHO、Ar2CO等)、则容易发生交叉羟醛反应。(Claisen-Schmidt反応) [3]
- 实验步骤
- 实验技巧
- 参考文献
[2] (a) Inoue, M.; Sato, T.; Hirama, M. Angew. Chem. Int. Ed. 2006, 45, 4843. doi:10.1002/anie.200601358 (b) Inoue, M.; Lee, N.; Kasuya, S.; Sato, T.; Hirama, M.; Moriyama, M.; Fukuyama, Y. J. Org. Chem. 2007, 72, 3065. DOI: 10.1021/jo0700474
[3] (a) Schmidt, J. G. Ber. 1880, 13, 2342. (b) Claisen, L. Ber. 1890, 23, 976.