作者:石油醚
导读:
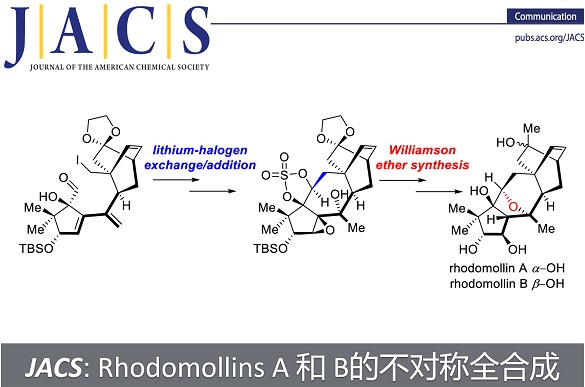
近日,兰州大学阳铭教授团队在J. Am. Chem. Soc.上,以 “Total Syntheses of Rhodomollins A and B.” 为题,报道了木藜芦烷二萜天然产物Rhodomollins A 和 B的首次不对称全合成。 其中,关键步骤主要涉及: Stille偶联 (Stille coupling)以及锂-卤素交换/分子内对醛的亲核加成 (lithium-halogen exchange/intramolecular nucleophilic addition to the aldehyde)构建四环碳骨架; 邻二醇环状硫酸酯的SN2反应 (intramolecular SN2 substitution of cyclic sulfate of 1,2-diols (Williamson ether synthesis).)构筑氧杂-双环[3.2.1]结构; Payne/Meinwald重排(Payne/Meinwald rearrangement)以及后续氧化还原调节分子的氧化态。
“Total Syntheses of Rhodomollins A and B
Weizhao Zhao, Duo Zhang, Yuran Wang, and Ming Yang* J. Am. Chem. Soc., 2023, ASAP. doi: 10.1021/jacs.3c12249”
正文
木藜芦烷二萜天然产物Rhodomollins A和B是由中国医学科学院药物研究所庾石山研究员及其同事于2016年从Rhododendron mole.中分离获得(Figure 1)。近日,阳铭教授以汇聚式的策略实现了木藜芦烷二萜天然产物Rhodomollins A 和 B的首次不对称全合成,并发表于J. Am. Chem. Soc.上。
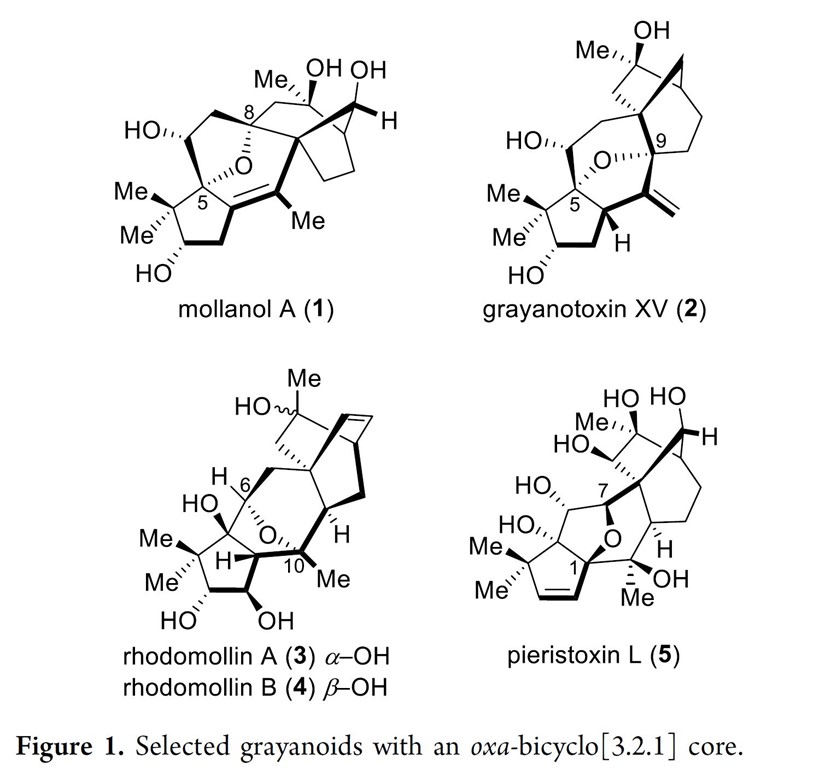
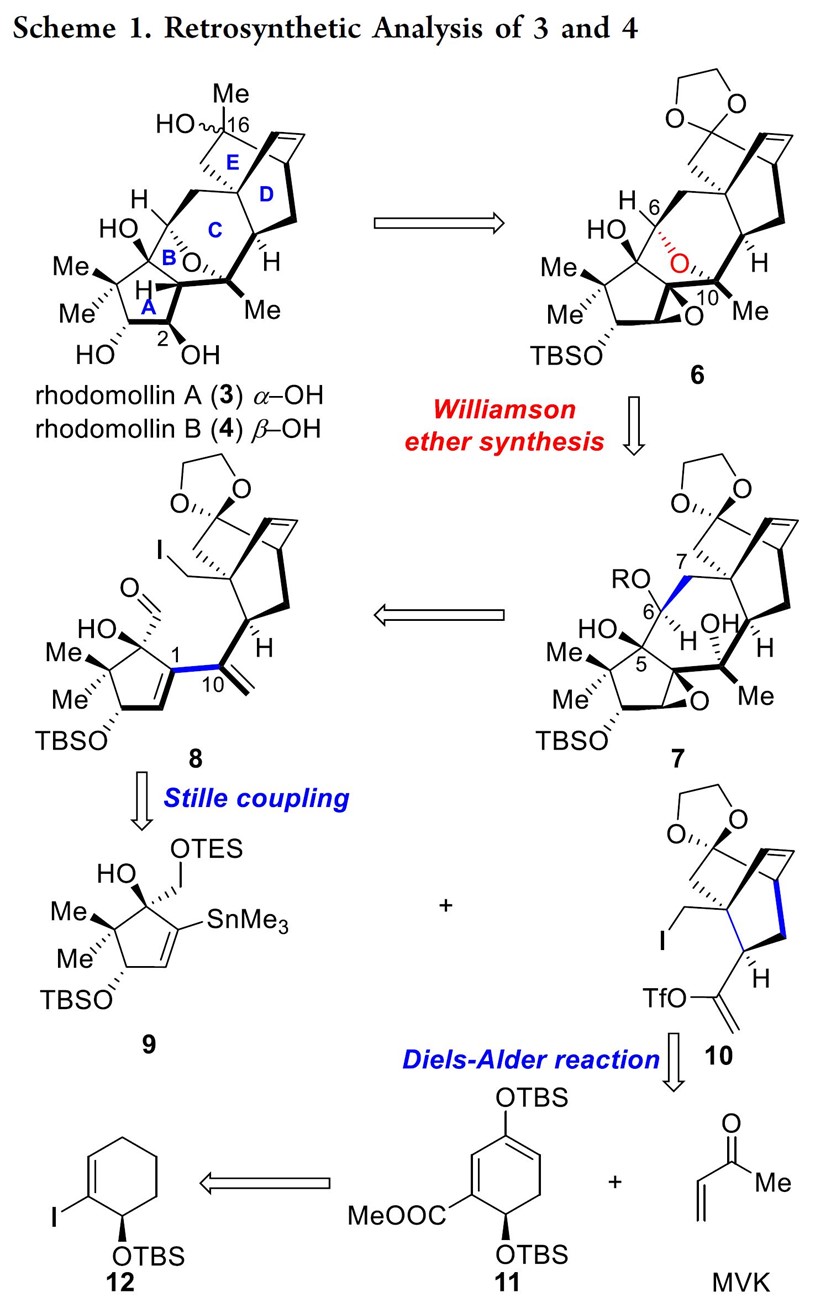
与其他木藜芦烷二萜天然产物不同,Rhodomollins A和B拥有着全新的5/5/6/6/6五环骨架,其中包括相互稠合的全碳[2.2.2]桥环结构和氧杂[3.2.1]桥环结构。基于上述结构,作者对Rhodomollins A(3)和B(4)进行了相关的逆合成分析(Scheme 1),即12通过一系列官能团变化获得砌块11,11 与甲基乙烯基甲酮(methyl vinyl ketone,MVK)经Diels-Alder反应合成双环[2,2,2]辛烷结构10。随后,D/E环片段10和A环片段9经Stille偶联获得关键砌块8,8可通过Nozaki-Hiyama-Kishi (NHK)反应[2]、Barbier反应[2]、或锂-卤素交换/亲核加成合成砌块7,7通过Williamson醚合成完成氧杂[3.2.1]桥环的合成6。最后,6经一系列官能团化完成Rhodomollins A和B的全合成。
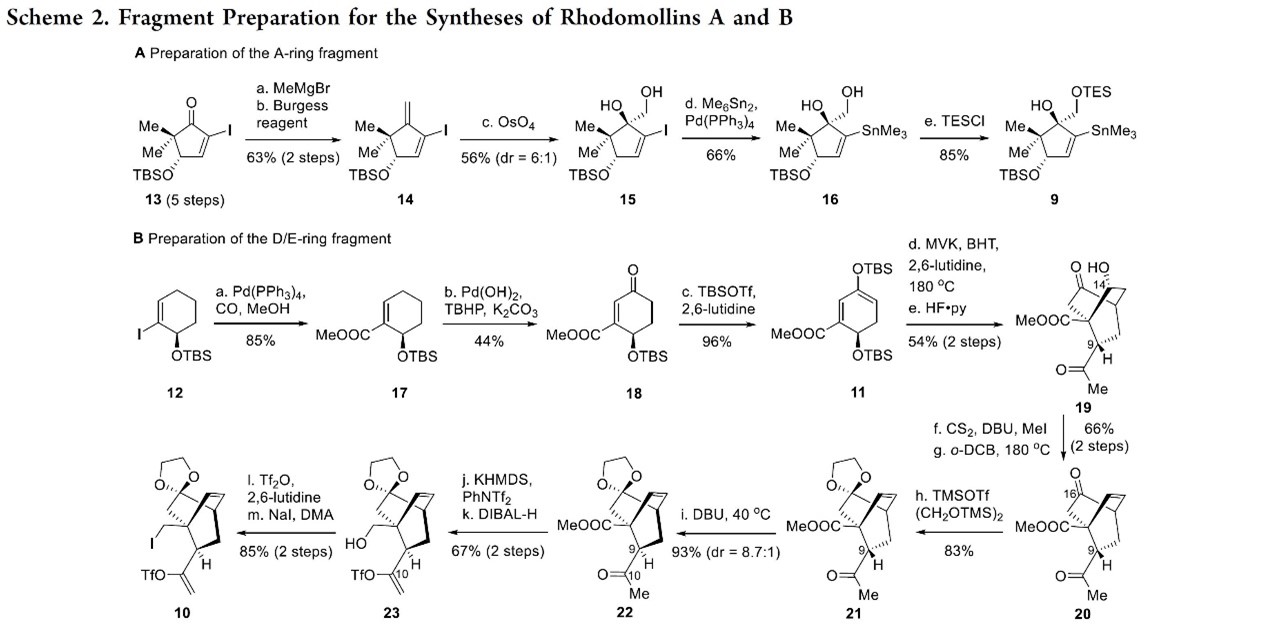
首先,作者对构建A环和D/E环砌块进行了合成,如Scheme 2所示。

其次,作者对四环碳骨架进行了合成,如Scheme 3所示。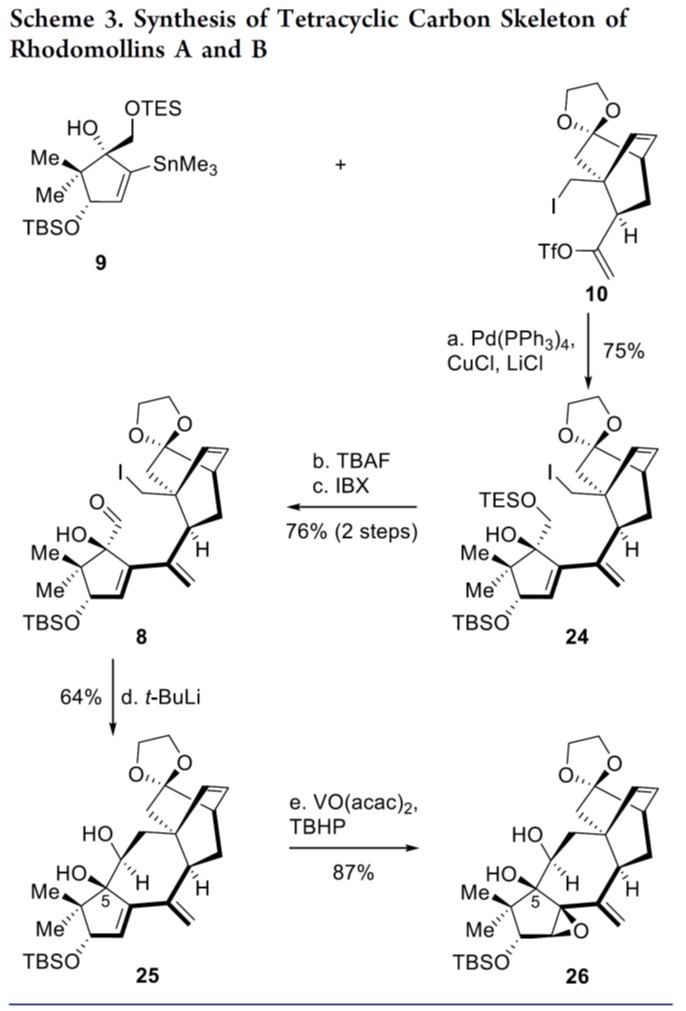
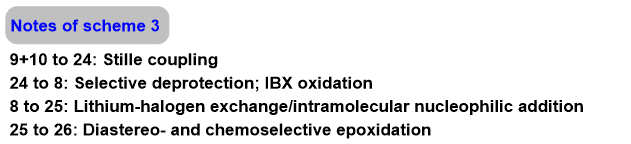
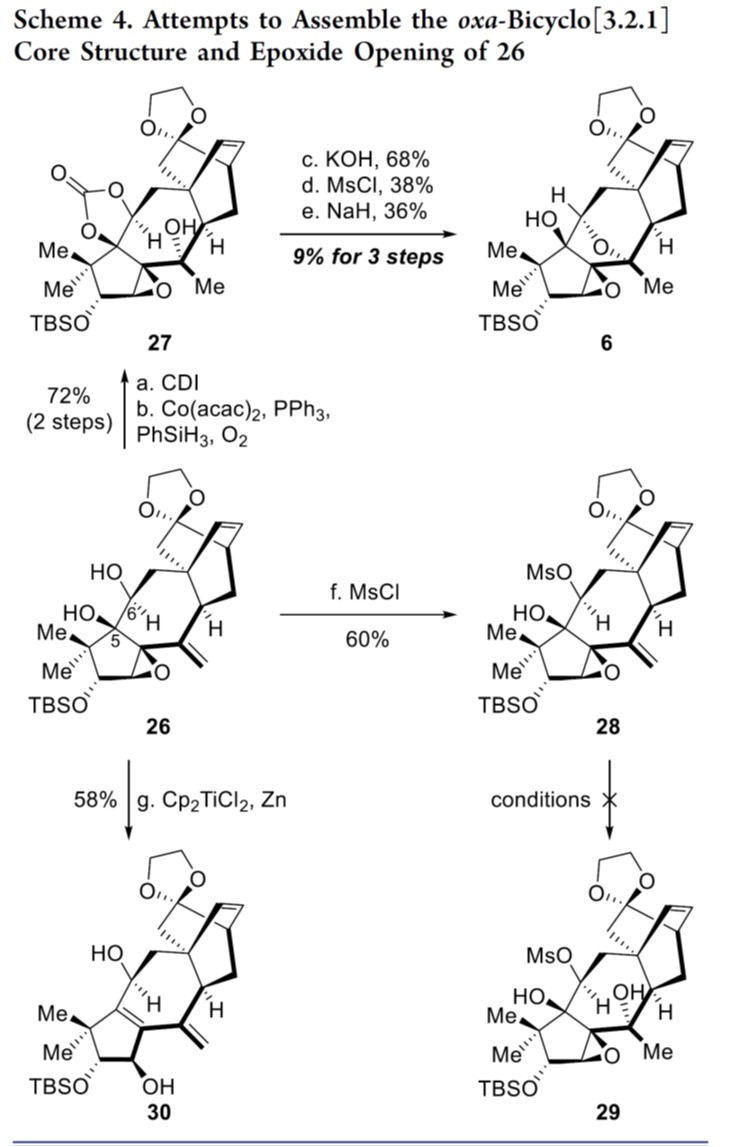
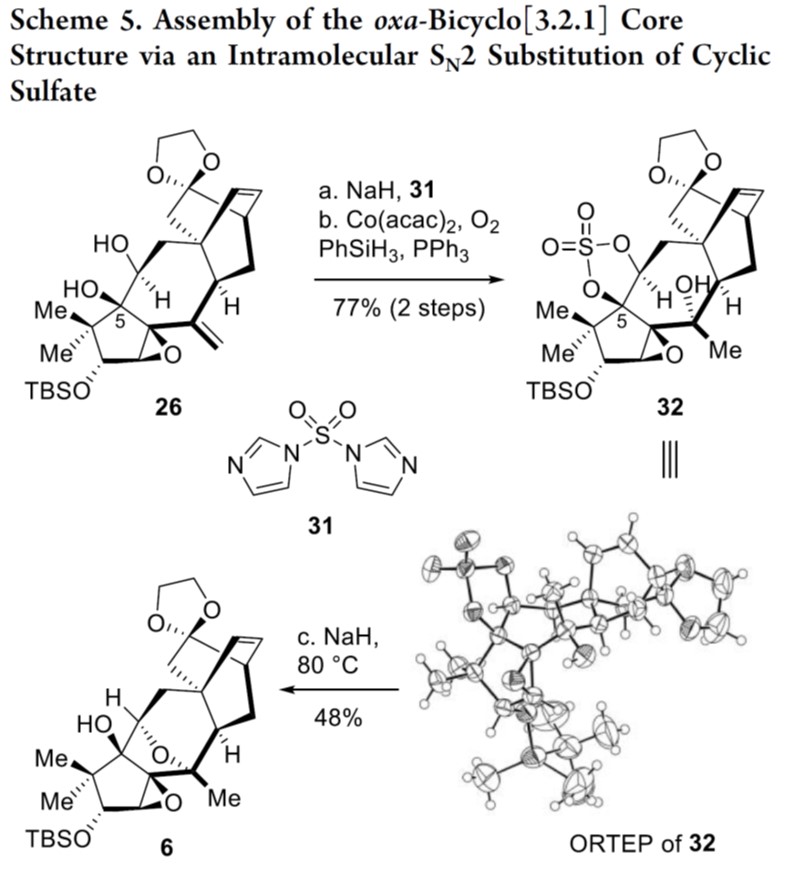
随后,作者对氧杂[3.2.1]桥环骨架进行了合成尝试,如Scheme 4和5所示。


作者希望引入C2羟基并安装C16甲基来完成3和4的全合成,如Schemes 6-7所示。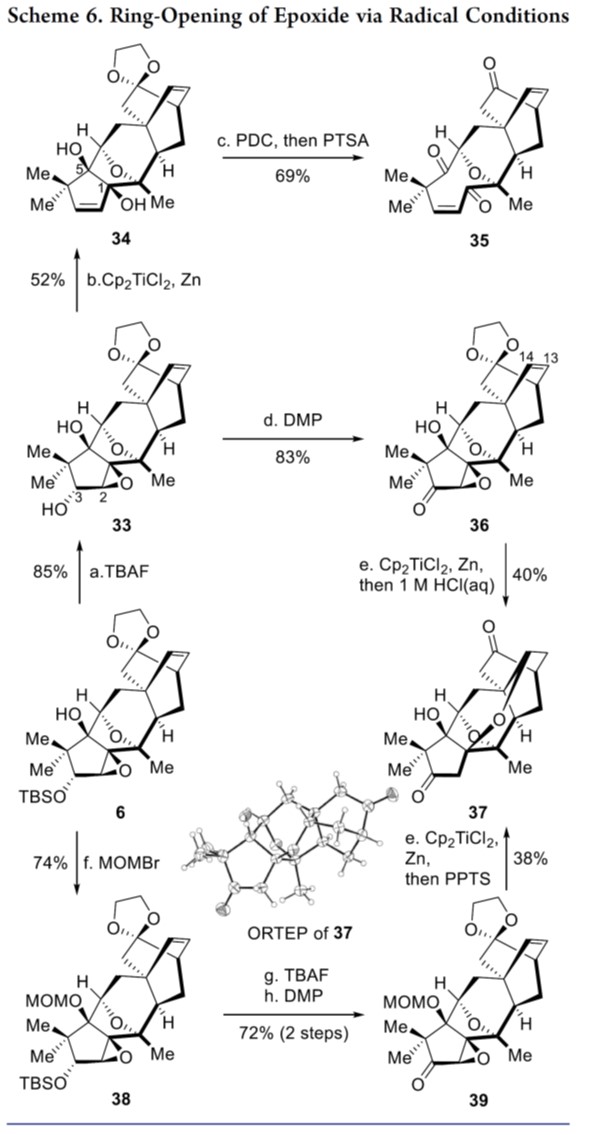

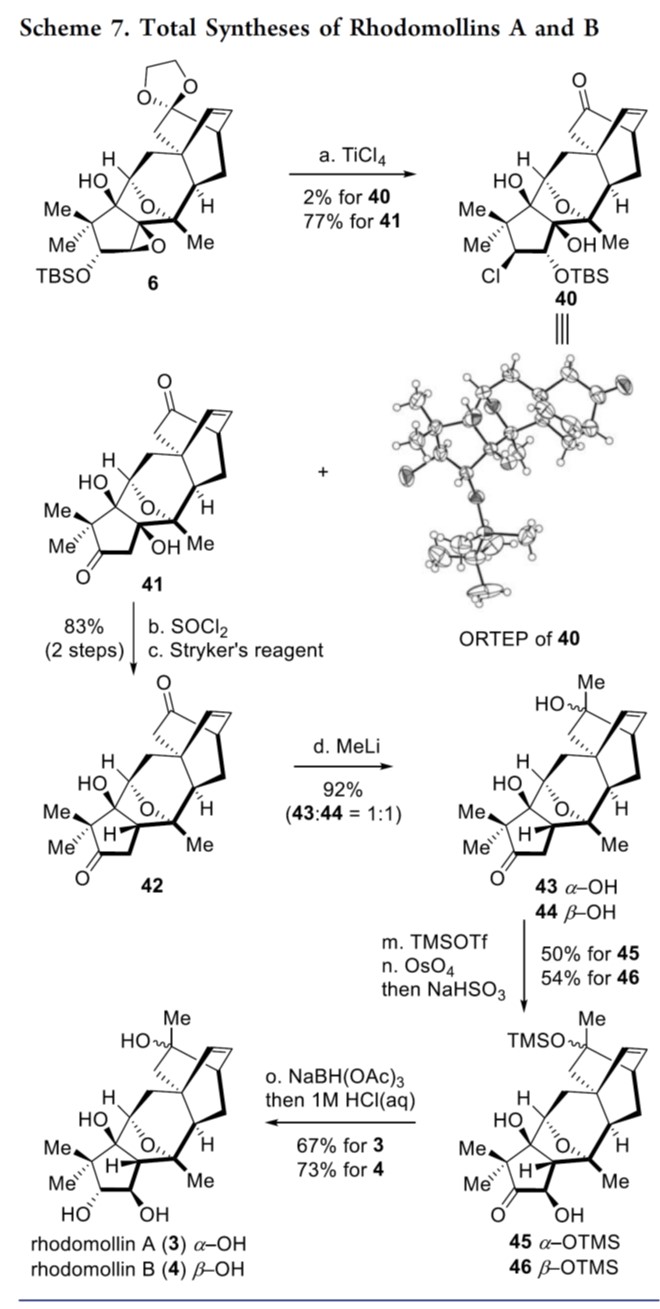

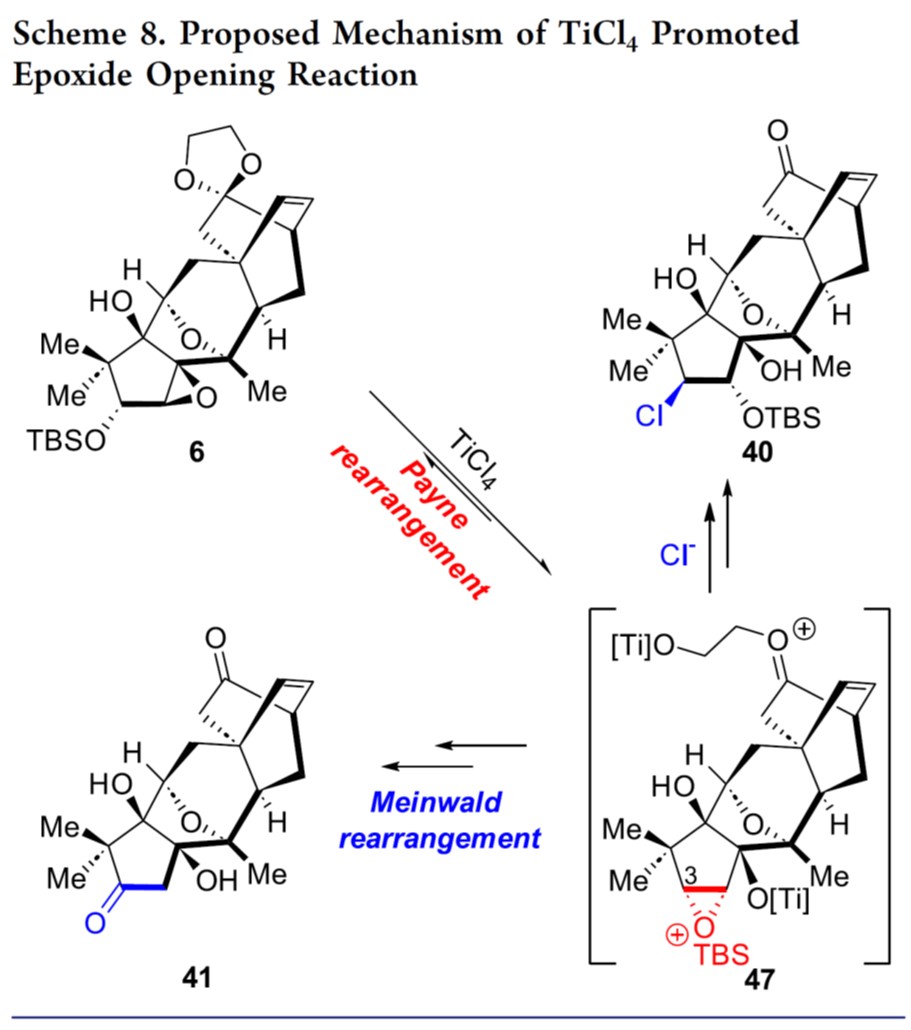
最后,基于相关文献[6],作者对6生成40和41的反应机理进行了研究,如Scheme 8所示。
总结, 阳铭教授团队以汇聚式的策略实现了木藜芦烷二萜天然产物Rhodomollins A 和 B的首次不对称全合成。 其中,关键步骤主要涉及: Stille偶联 (Stille coupling)以及锂-卤素交换/分子内对醛的亲核加成 (lithium-halogen exchange/intramolecular nucleophilic addition to the aldehyde)构建四环碳骨架; 邻二醇环状硫酸酯的SN2反应 (intramolecular SN2 substitution of cyclic sulfate of 1,2-diols (Williamson ether synthesis).)构筑氧杂-双环[3.2.1]结构; Payne/Meinwald重排(Payne/Meinwald rearrangement)以及后续氧化还原调节分子的氧化态。
参考文献:
- [1] Y. Li, Y.-B. Liu, H.-M. Yan, Y.-L. Liu, Y.-H. Li, H.-N. Lv, S.-G. Ma, J. Qu, S.-S. Yu, Sci. Rep. 2016, 6, 36752. doi:10.1038/srep36752.
- [2] D.-S. Kim, C.-G. Dong, J. T. Kim, H. Guo, J. Huang, P. S. Tiseni, Y. Kishi, J. Am. Chem. Soc. 2009, 131, 15636. doi:10.1021/ja9058475.
- [3] G. A. Molander, J. B. Etter, J. Org. Chem. 1986, 51, 1778. doi:10.1021/jo00360a025.
- [4] M. J. Classen, M. N. A. Böcker, R. Roth, W. M. Amberg, E. M. Carreira, J. Am. Chem. Soc. 2021, 143, 8261. doi:10.1021/jacs.1c04210.
- [5] C. Dou, M. Yang, Synlett 2023. doi:10.1055/s-0041-1738436.
- [6] F. He, S. Feng, Y. Zhao, H. Shi, X. Duan, H. Li, X. Xie, X. She, Angew. Chem. Int. Ed. 2022, 61, e202205439. doi:10.1002/anie.202205439.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.
















No comments yet.