导读
手性1,2-二胺化合物在生物活性天然产物和药物化合物中具有重要的应用价值。另外,它们可作为手性配体广泛应用于过渡金属催化的不对称合成反应中,同时也是高效的手性有机催化剂。[1]因此,已发展多种方法应用于他们的不对称合成。目前报道的合成方法可以分为三种类型:固有二胺骨架的转化、碳-氮键或碳-碳键的形成及转化。在第三类型中,含有碳原子连有含氮的官能团,如硝基、异氰基、异硫氰酸酯基、或酮亚胺通常被用作亲核试剂与醛亚胺反应。如果是酮亚胺,则在用碱进行去质子化时产生了2-氮杂烯丙基阴离子,将表现出两种与亲电试剂的反应途径,即α-加成和α’-加成(图1a)。[2]通常,其他的官能团如酯基,腈基,或磷酯基等被用来稳定2-氮杂烯丙基阴离子(R1 = CO2R,CN,或P(O)(OR)2)。此外,在酮亚胺的α位上引入强吸电子基团会降低pKa的值,因此能够容易地与醛亚胺发生反应,在手性催化剂的存在下生成手性1,2-二胺衍生物。2008年,Hou,Wu等发展了一例高对映选择性的催化不对称曼尼希反应,获得N-(二苯基亚甲基)甘氨酸甲酯(图1b)。[3]通过改变配体(FOXAP)的电子性质,可以高非对映选择性合成顺式和反式1,2-二胺衍生物。此外,赵课题组还发现羰基催化的叔丁基甘氨酸盐酸盐的仿生不对称曼尼希反应,得到手性反式-1,2-二胺衍生物,具有出色的非对映选择性和对映选择性。
除稳定的2-氮杂烯丙基阴离子外,半稳定的2-氮杂烯丙基阴离子(R1为芳基)和非稳定的2-氮杂烯丙基阴离子(R1为H或烷基)也被用作亲核试剂,用于醛亚胺的α-加成反应。作为该领域的一项突破,Kobayashi课题组发展了KOtBu-18-crown-6催化的(9-亚芴基)氨基链烷烃和Dpp-醛亚胺的曼尼希反应。然而,在催化不对称合成时只得到具有74% ee的手性顺式-1,2-二胺衍生物。在2018年,尽管Reddy课题组通过使用Davis–Ellman的亚胺开发了非对映选择性合成,但很少实现催化不对称合成。同年,Malcolmson课题组报道了一例还原偶联反应,利用亚胺和酮亚胺得到反式-1,2-二胺衍生物,具有优异的非对映选择性和对映选择性,在该反应中,通过用(Ph-BPE)CuH还原氮杂二烯生成了催化量的不稳定的2-氮杂烯丙基阴离子。
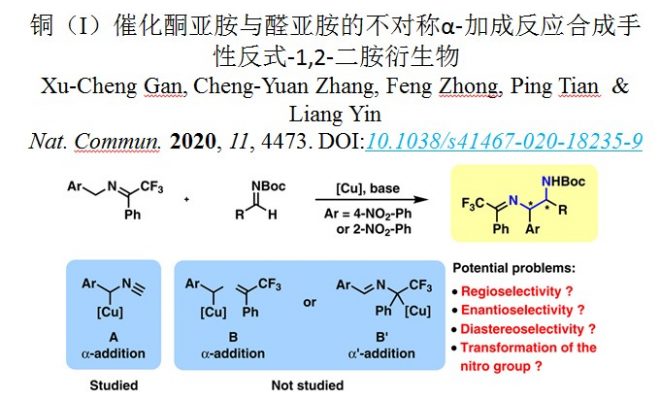
亚胺通常作为用作亲电试剂与各种亲核试剂反应,而2-氮杂烯丙基阴离子的α’-加成被称为亚胺极性反转加成。在2015年,Deng课题组发展了一例催化不对称酮亚胺极性反转反应,即三氟丙酮、4-NO2苄胺衍生的酮亚胺和α,β-不饱和醛进行反应(图1c)。[4]在有机催化剂金鸡纳碱存在下,酮亚胺通过去质子化生成2-氮杂烯丙基阴离子,进一步发生α,β-不饱和醛的α‘-加成(1,4-共轭加成)。但是,这种2-氮杂烯丙基阴离子的α-加成在不对称催化中发展较少。2015年,Shibasaki和Kumagai提出了一种苄基铜(I)物种A,该物种与醛亚胺反应,通过α-加成生成手性1,2-二芳基乙二胺衍生物。因此,可以预见的是,在铜(I)配合物存在下,通过将酮亚胺的去质子化,可以生成苄基铜(I)物质B,该配合物可以与另一种苄基铜(I)物质B’形成平衡(图1d)。物种B将发生α’-加成,而物种B’将发生α‘-加成。铜(I)-双膦配合物以及带有Ph和CF3的α’-位置均存在明显的空间位阻,因此不利于α’-加成。显然,将α-苄基铜(I)加至醛亚胺将产生手性1,2-二胺衍生物。基于以上研究背景,上海大学中医药大学田平和上海有机所殷亮利用三氟苯乙酮和2-或4-NO2-苄胺衍生的酮亚胺催化不对称α-加成到醛亚胺上,以中等至高收率、中等到高的非对映选择性和优异对映选择性得到了一系列反式-1,2-二胺衍生物。相关成果发表于:
“Synthesis of chiral anti-1,2-diamine derivativesthrough copper(I)-catalyzed asymmetric α-additionof ketimines to aldimines”
Xu-Cheng Gan, Cheng-Yuan Zhang, Feng Zhong, Ping Tian* & Liang Yin*
Nat. Commun. 2020, 11, 4473. DOI:10.1038/s41467-020-18235-9
图1. 基于2-氮杂烯丙基阴离子催化不对称加成
论文概要
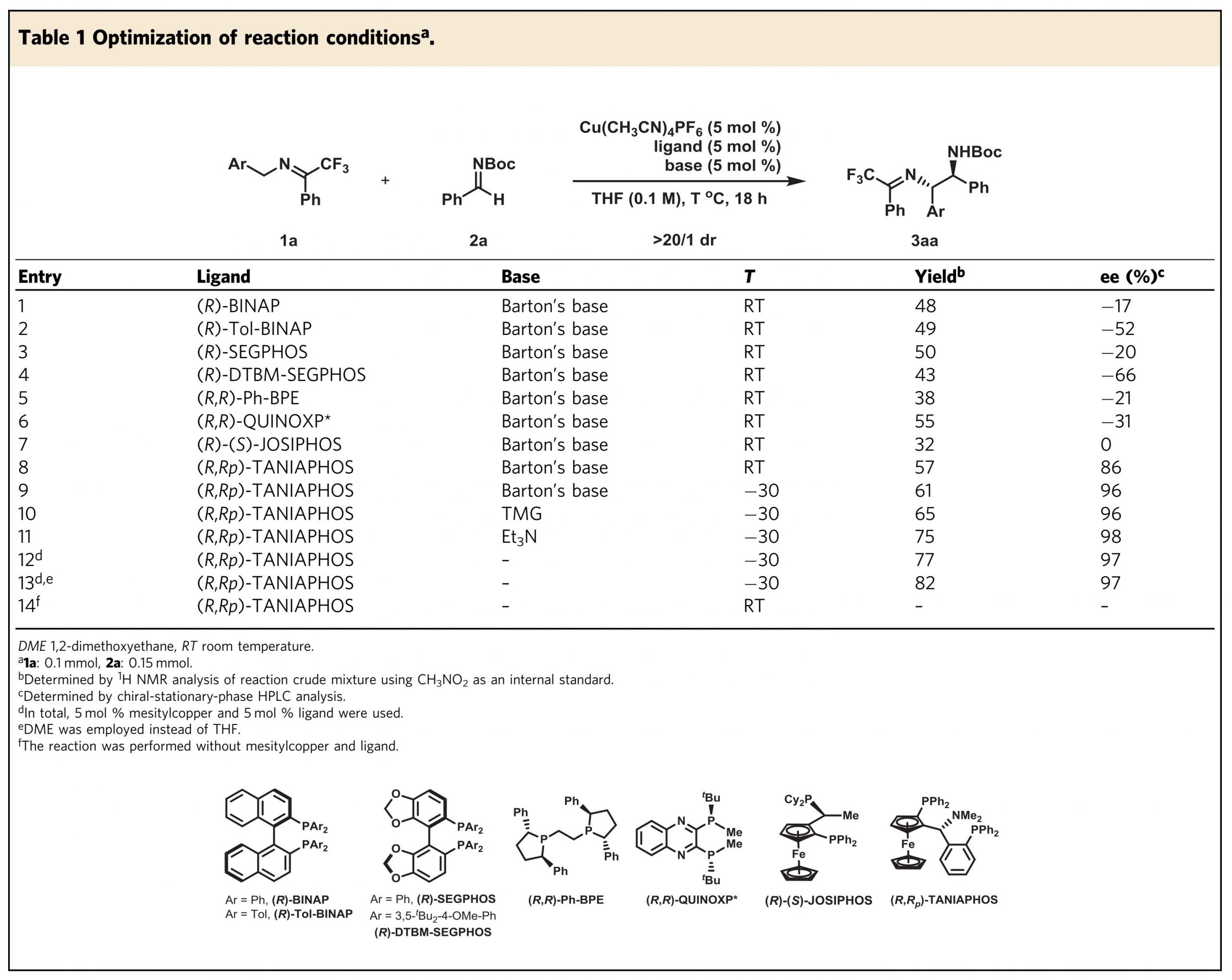
首先,酮亚胺1a和N-Boc-醛亚胺2a为模板底物进行反应,在5mol%的Cu(CH3CN)4PF6、5mol% (R)-BINAP,和5mol% Barton碱条件下进行(表1,entry1)。加成反应顺利进行,以48%的收率和17%的ee得到产物3aa。通过筛选市售的双膦配体,发现(R, RP)-TANIAPHOS有利于对映选择性(entries 2-8)。将反应温度降低至–30°C,得到ee为96%(entry9)。其他有机碱,例如TMG和Et3N也很好地催化该反应,产率更高,且对映选择性保持(entries 10-11)。使用Mesitylcopper–(R, RP)-TANIAPHOS代替Cu(CH3CN)4PF6-(R, RP)-TANIAPHOS有机碱的组合,有相同的反应效率(entry 12)。将溶剂从THF更改为DME收率略有提高(entry 13)。此外,作者还测试了其他溶剂(包括正辛烷,甲苯,均三甲苯,PhCF3和DCM),但未观察到更好的结果。最终作者选择了entry 13中显示的条件作为优化的反应条件。没有间苯二酚铜配合物,该反应在室温下根本不进行(entry14),除了N-Boc-醛亚胺2a以外,作者还在该反应条件下评估了其他苯甲醛衍生的醛亚胺,例如N-Cbz-醛亚胺,N-Ts-醛亚胺等。但是,并没有获得出色的结果。
表1. 分子间烯烃双官能化反应
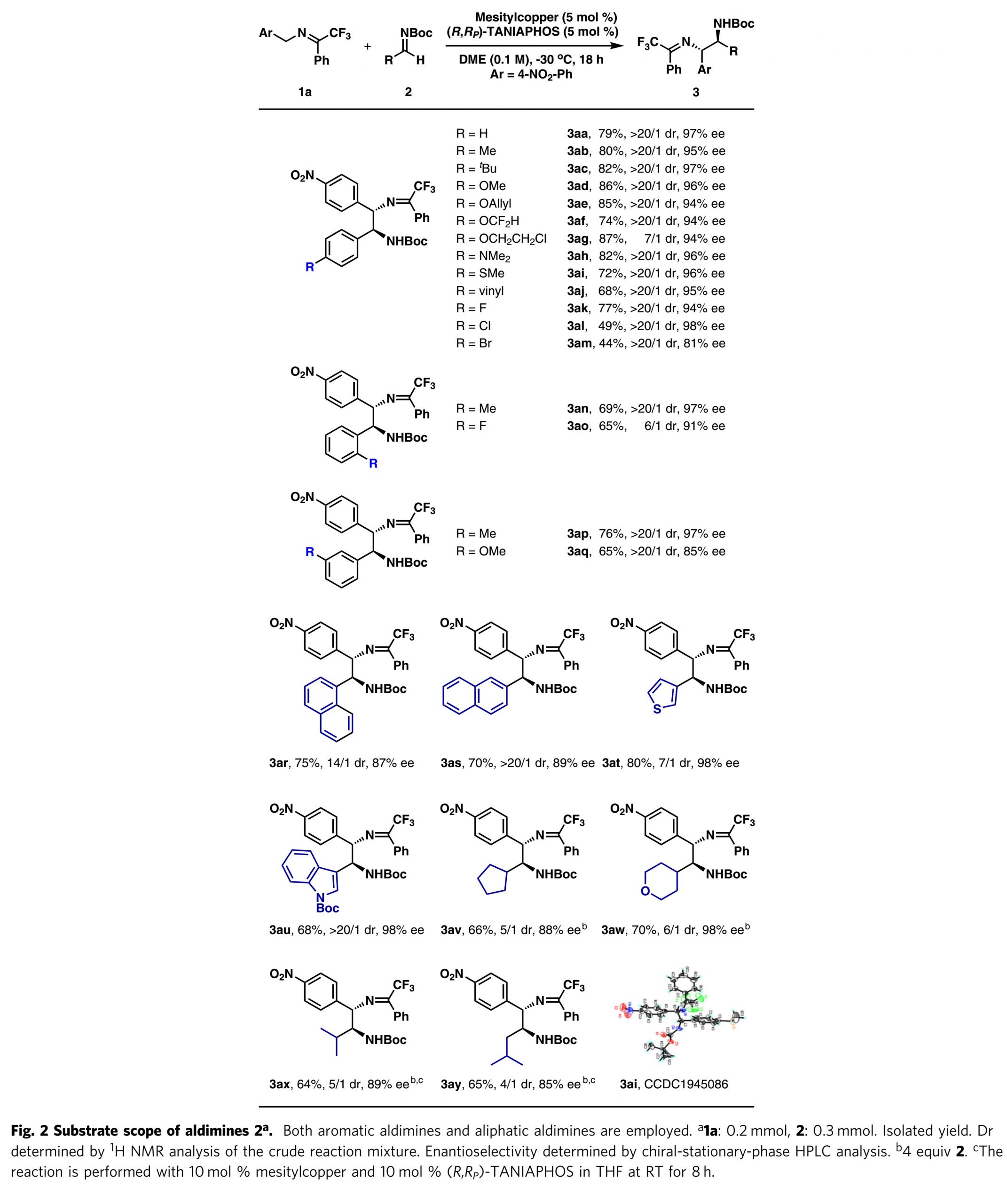
在获得上述最佳反应条件之后,作者研究了亚胺的底物范围(图2)。对于含有对位取代基的芳香醛亚胺,给电子基和吸电子基都具有良好的耐受性,获得7/1-> 20/1 dr和81%-98%ee的产物3aa–3am。然而,具有吸电子基团的芳族醛亚胺收率较低。含有邻位或间位取代基的芳族醛亚胺也是有效的反应底物,均以良好的反应结果得到目标产物(3an-3aq)。此外,1-萘基亚胺和2-萘基亚胺都很好地适用于该反应(3ar-3as)。两种含有2-噻吩基和N-Boc-3-吲哚基的杂芳族醛亚胺的反应也非常有效(3at–3au)。应该提到的是,在几种情况下(3ag, 3ao和3at)具有中等非对映选择性。然后,作者研究了脂肪族醛亚胺,发现具有环烷基取代基的醛亚胺也是令人满意的底物(3av-3aw)。α-支链亚胺(2x)和β-支链亚胺(2y)为底物,反应在THF中于室温进行,得到产品(3ax-3ay),具有中等的非对映选择性和高的对映选择性。
图2. 亚胺底物拓展
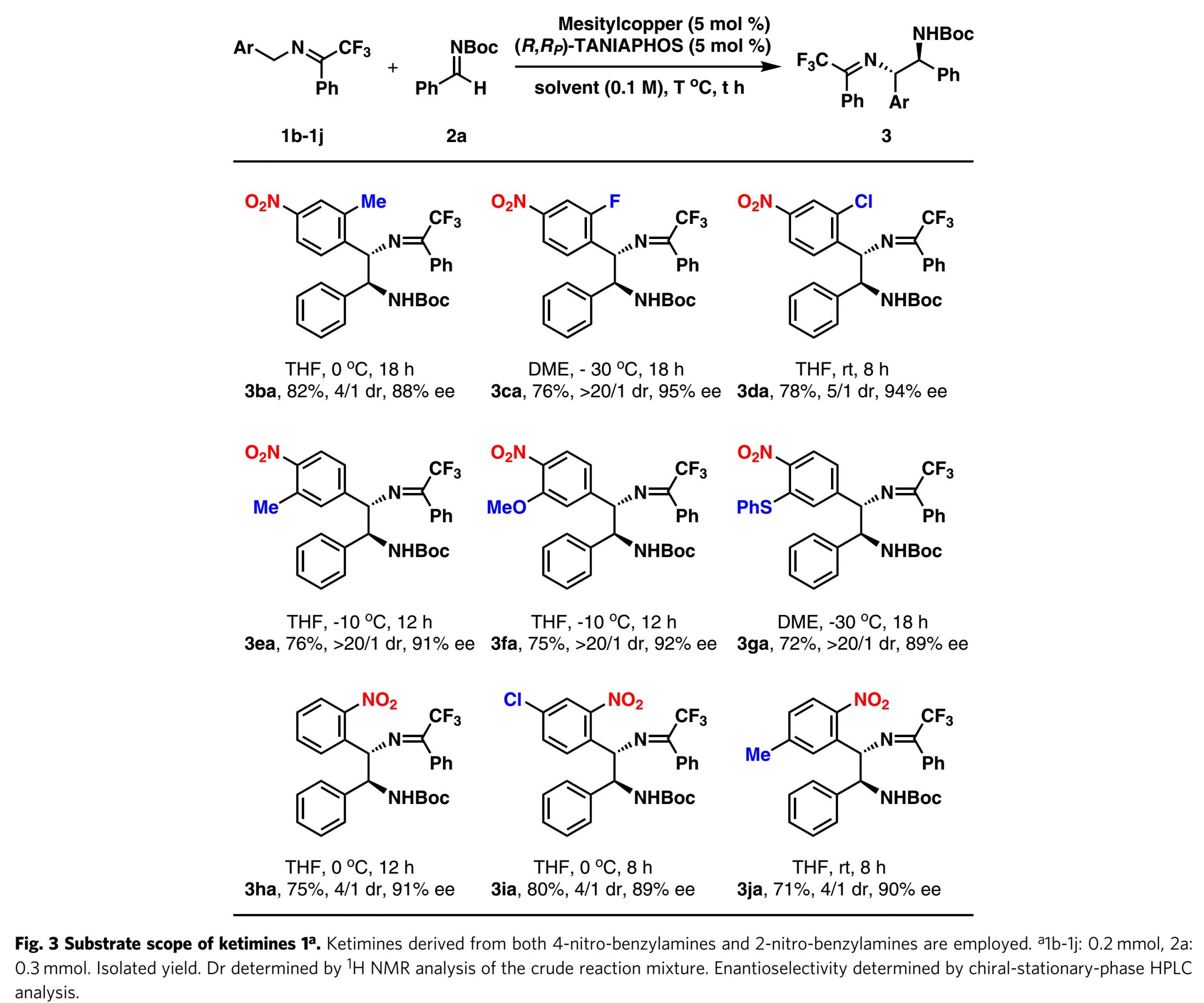
如图3所示,作者对酮亚胺进行了简单的研究。为了获得更好的结果,略微改变了反应条件(包括反应温度和溶剂)。一般而言,较低的反应温度有利于较高的对映选择性,而较高的反应温度有利于较高的收率。在许多情况下,THF是比DME更好的溶剂,这导致在高于−30°C的反应温度下具有更高的对映选择性。如图3所示,对于4-硝基苄基亚胺,在2-位(3ba,3ca和3da)成功地接入了甲基,氟和氯等取代基。然而,随着取代基的空间位阻的增加,非对映选择性降低。此外,可以在3-位引入取代基,例如甲基,甲氧基和噻吩基,观察到高的非对映选择性和对映选择性(3ea,3fa和3ga)。最后,作者研究了2-硝基苄基亚胺1h,将其转化为产物3ha,收率为75%,dr为4/1,ee为91%。在亚胺3i和3j的反应中观察到相似的反应效率。应该指出的是,2-硝基苄基亚胺的反应以中等的非对映选择性进行。根据3ai的立体结构假定3ba–3ja的绝对构型。4-COOMe, 4-CF3, 4-P(O)Ph2, 4-CN,和 4-SO2CF3也引入到酮亚胺。但是,即使在室温下,4-COOMe, 4-CF3, 4-P(O)Ph2, 4-CN的反应也不能令人满意,表明去质子化过程效率较低。带有4-SO2CF3的酮亚胺是合适的底物,其与醛亚胺2a反应,以53%的收率和91%的ee得到相应的产物。
图3. 酮亚胺适应范围
如图4所示,在-20°C下用2 mol%的铜催化剂和2 mol% (R,RP)-TANIAPHOS成功地完成了3aa的克级制备,得到1.15克3aa,收率75%,> 20/1 dr和96%ee,并能容易地实现硝基的进一步转化。通过相关文献的反应步骤,以77%的收率得到亚硝基4,其可用作潜在地有机合成中间体。在MeOH中的12 M HCl中进行C=N部分和N-Boc部分的分解,得到所需的反式-1,2-二胺,用TsCl保护,分5步以81%的收率得到5。在1 atm H2下,在Pd/C存在下,5中的硝基容易以98%的收率还原为胺基(6)。有趣的是,5用3-甲基丁-3-烯-1-醇进行了Fe(acac)3催化的自由基加氢胺化反应,以59%的收率得到α-叔胺7。
图4. 衍生化反应
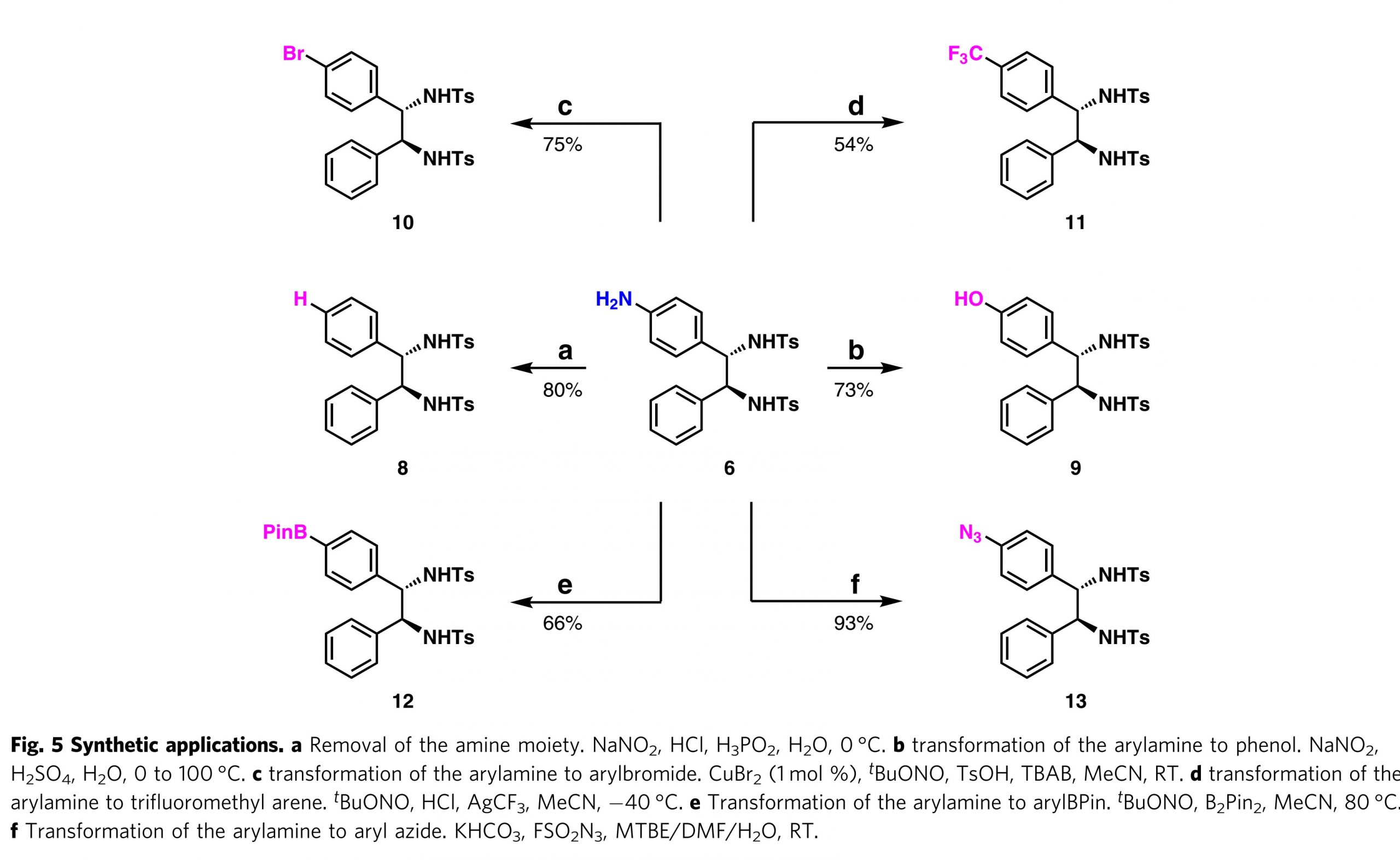
芳香族胺6可通过Sandmeyer反应进一步转化(图5)。NH2基团的去除通过传统的Sandmeyer反应条件进行,其以80%的收率得到递送1,2-二芳基二胺8。芳胺6向苯酚9的转化以73%的收率实现。芳基溴化物10的制备也以75%的收率完成。进行脱氨基三氟甲基化以得到11,收率为54%。芳基胺6至芳基硼酸酯12的转化以66%的收率实现。更有趣的是,由6以93%的收率合成了叠氮化芳基13。
图5. 其它衍生化转化
论文总结评价
上海大学中医药大学田平和上海有机所殷亮等开发了铜(I)催化的,由三氟苯乙酮和2-或4-NO2-苄胺衍生的酮亚胺与N-Boc-醛亚胺的不对称α-加成反应,生成一系列手性反式-1,2-二胺衍生物,具有中到高的非对映选择性和优异的对映选择性。同时,该反应具有广泛的底物范围,并且产物中的硝基用作合成前体,可进行进一步的衍生化。此外,由硝基还原产生的芳基胺是Sandmeyer反应的极好底物,该反应已转化为芳烃,苯酚,芳基溴化物,三氟芳烃和芳基硼酸酯,芳基叠氮化合物等。
参考文献
- [1] G-Q. Lin,, M.-H. Xu, Y.-W. Zhong, & X.-W. Sun, Acc. Chem. Res. 2008,41, 831-840. DOI: 10.1021/ar7002623
- [2] S. Tang, X. Zhang, J. Sun, D. Niu, & J. J. Chruma, Chem. Rev. 2018, 118, 10393-10457.DOI: 10.1021/acs.chemrev.8b00349
- [3] X.-X. Yan, et al. J. Am. Chem. Soc. 2008, 130, 14362-14363. DOI: 10.1021/ja804527r
- [4] Y. Wu, L. Hu, Z. Li, & L. Deng, Nature 2015, 523, 445-450. DOI: 10.1038/nature14617
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!
























No comments yet.