本文作者:杉杉
导读
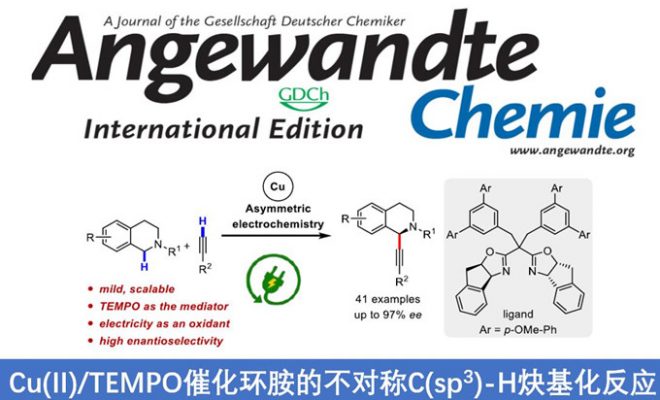
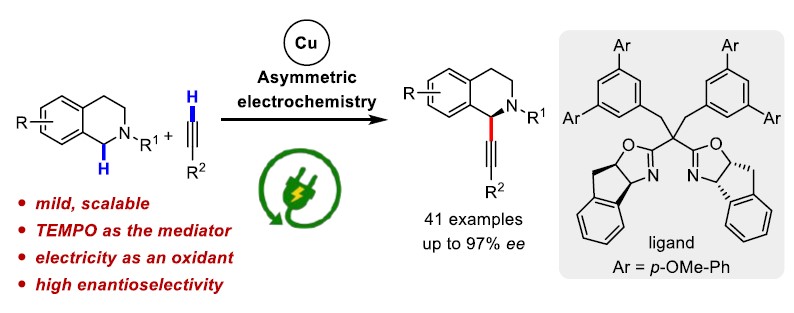
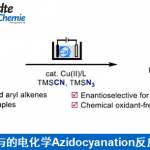
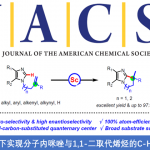
近日,上海有机所梅天胜教授课题组在德国应化杂志(Angewandte Chemie-International Edition)发表论文,在Cu(II)/TEMPO共催化下,通过电化学途径,实现环胺与炔烃的不对称Shono氧化交叉偶联反应,获得具有良好至优异对映选择性的C1-炔基化四氢异喹啉衍生物。此外,使用TEMPO作为助催化剂,不仅能够促进四氢异喹啉氧化成亚胺离子,同时也能够降低反应的氧化电位。
Cu(II)/TEMPO-Catalyzed Enantioselective C(sp3)–H Alkynylationof Tertiary Cyclic Amines via Shono-type Oxidation
Pei-Sen Gao, Xin-Jun Weng, Zhen-Hua Wang, Chao Zheng, Bing Sun, Zhi-Hao Chen, Shu-Li You, and Tian-Sheng Mei*
Angew. Chem. Int. Ed. ASAP DOI:10.1002/anie.202005099
正文
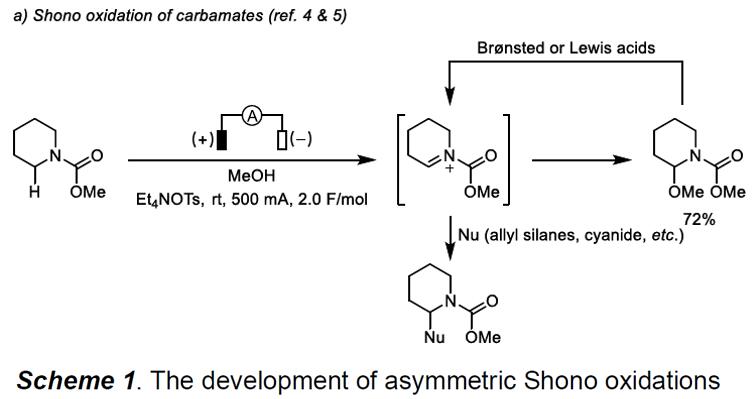
近年来,由于电流能够代替化学氧化剂或还原剂,因此电化学合成已成为一种环境友好的合成方法。同时,通过对电势和电流的调节,可实现一些新颖的转换。早在1975年,Shono及其同事证明了氨基甲酸酯可在阳极氧化为N-氨基甲酰基亚胺离子,随后与甲醇反应,生成α-甲氧基化产物(Scheme 1a)。同时,在布朗斯特酸或路易斯酸存在时,可将生成的N,O-氨基产物转化为亚胺离子,再与多种亲核试剂反应,如烯丙基硅烷、氰化物、氟化物、呋喃、异氰化物等,从而作为实现胺的α-位官能团化有效方案(作为研究最广泛的阳极氧化反应之一)。尽管如此,涉及Shono-type氧化C-C偶联的不对称方法有待开发。
早期的不对称Shono型氧化偶联反应常常依赖于手性辅助试剂,并且在使用烷基亲核试剂时,可获得不同水平的立体选择性。最近,Luo课题组开发了一种使用烯胺催化和电化学C-H氧化的方法,获得具有出色的非对映选择性和对映选择性的C1-烷基化四氢异喹啉(THIQ)衍生物(Scheme 1b)。同时,Ackermann、Lei和本课题组,通过电化学和过渡金属催化相结合,实现的定点选择性C-H功能化。因此,作者推测可通过阳极氧化与过渡金属催化相结合实现不对称的Shono型氧化反应。虽然已有文献报道实现THIQ和末端炔烃的不对称偶联反应,但通常需要化学氧化剂。早期,Li课题组报道了通过使用叔丁基过氧化氢(TBHP)作为化学氧化剂,实现THIQ和末端炔烃不对称偶联,获得中等对映选择性(5-74%ee)的C1-炔基化产物。最近,Feng课题组开发了一种用于这种不对称偶联的好氧型氧化方法,但反应时间长(24-72 h)。此外,该工作也面临一些基本挑战:(1)底物(胺)和产物(α-烷基化胺)的氧化电位差很小,导致所需产物的氧化;(2)亲核试剂本身在阳极的氧化;(3)手性配体在氧化条件下的稳定性。基于上述的讨论,作者设想通过使用氧化还原介体可能促进反应,因为若氧化底物(胺)所需的电势会减少,则亲核试剂和手性配体的反应效率降低的可能性较小。在本文中,上海有机所梅天胜教授课题组报道了在铜催化下,使用新型双恶唑啉配体,同时以TEMPO作为辅助催化剂,实现THIQ与炔烃的不对称Shono型氧化偶联反应,获得具有良好至优异对映选择性提供C1-炔基化产物(Scheme 1c)。
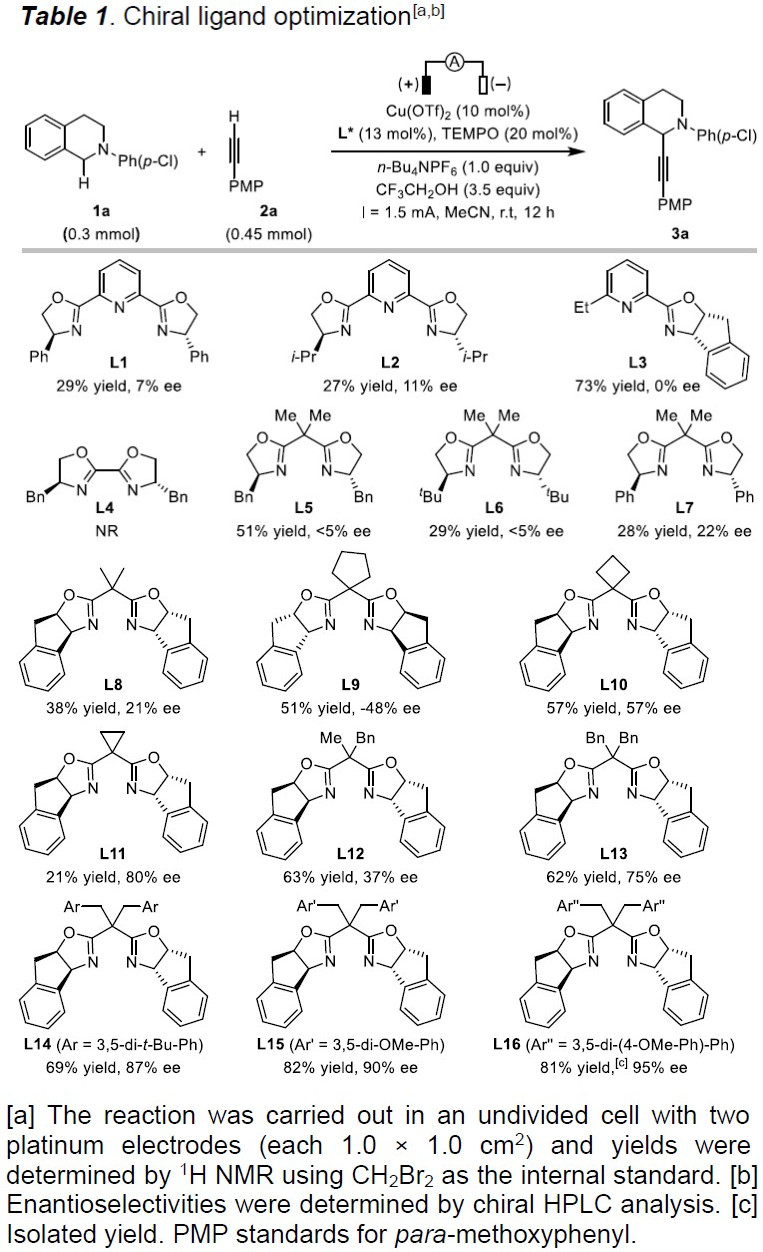
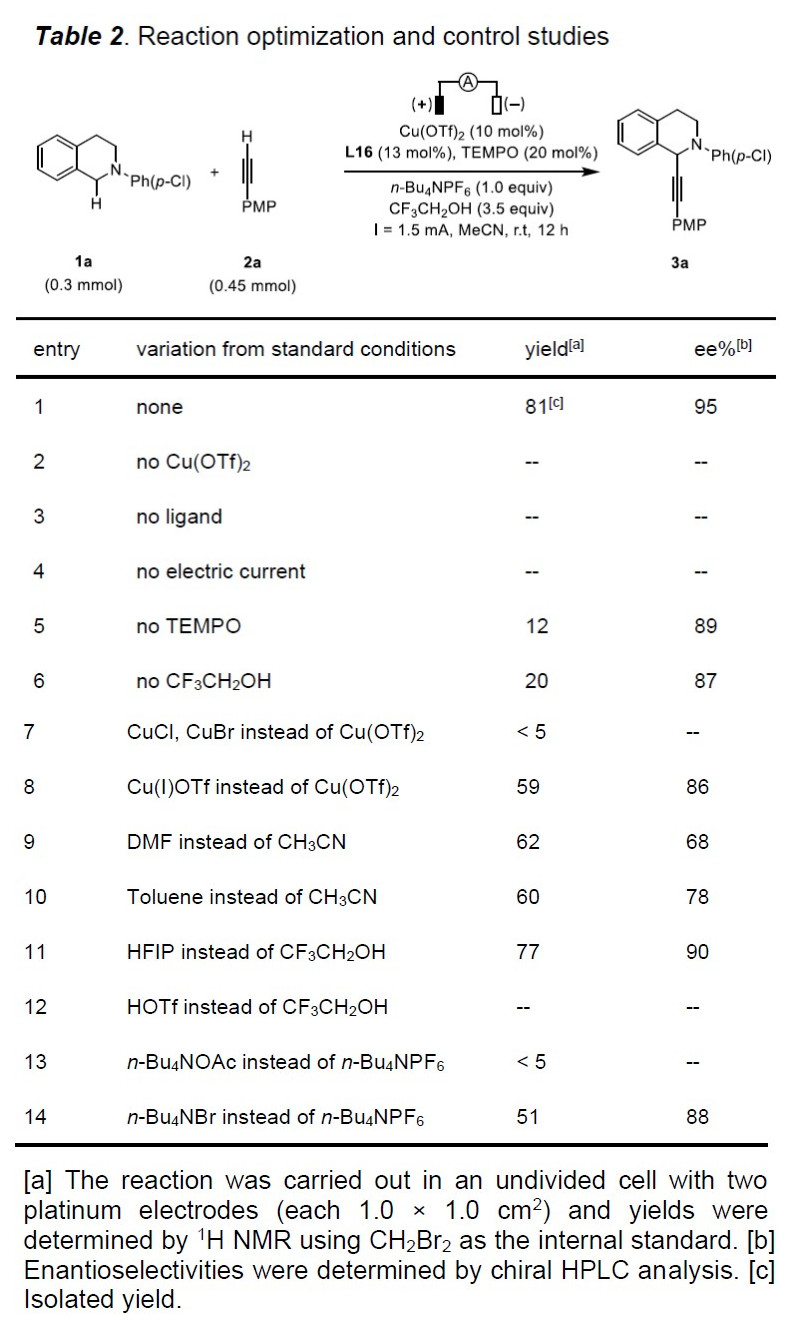
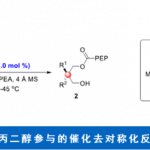
首先,作者以2-(4-氯苯基)-1,2,3,4-四氢异喹啉(1a)和1-乙炔基-4-甲氧基苯(2a)作为模型底物,以Cu(OTf)2(10 mol%)作为催化剂,TEMPO(20 mol%)作为助催化剂,在无隔膜电解槽中进行了相关配体的筛选(Table 1)。当使用三齿吡啶双恶唑啉(PyBox)(L1和L2)、双齿吡啶恶唑啉(L3)和烷基取代的双恶唑啉(Box)配体(L5和L6)可获得较低对映选择性产物。而使用双恶唑啉(L4)配体则不发生反应。但当使用苯基取代的Box(L7)时可将ee 提高至22%,收率28%。有趣的是,使用茚稠合的Box(L8)具有相似的对映选择性(ee为21%),但产率更高(38%)。由于Box配体的咬合角可能会对产品的对映体过量产生影响,因此作者测试了茚满稠合配体(L8–L11)上的各种取代基。具有环丙基的L11配体可获得80%ee的产物。Tang课题组证明可以通过Box配体侧链上的位阻来改善反应的对映选择性,因此作者改变了Box配体上的取代基(L12–L16)。反应结果表明,在苄基芳烃的间位上带有对甲氧基苯基基团的L16配体,可获得高达95%ee的产物3a(收率82%)。
随后,作者对反应的其它条件进行了筛选(Table 2)。对照实验表明,在反应无Cu催化剂、电流和配体时,则不发生反应(entries 2-4)。而在没有TEMPO时,3a的收率显着下降,对映选择性略有下降(entry 5)。而在没有CF3CH2OH时,仅获得20%收率和87%ee的产物3a(entry 6)。而对其他铜催化剂筛选中, Cu(OTf)2的效果最好(entries 7-8)。而改用其他溶剂时,收率和对映选择性都有所降低(entries 9-10)。而在电解质和添加剂筛选中, n-Bu4NPF6和CF3CH2OH的效果最佳(entries 11-14)。
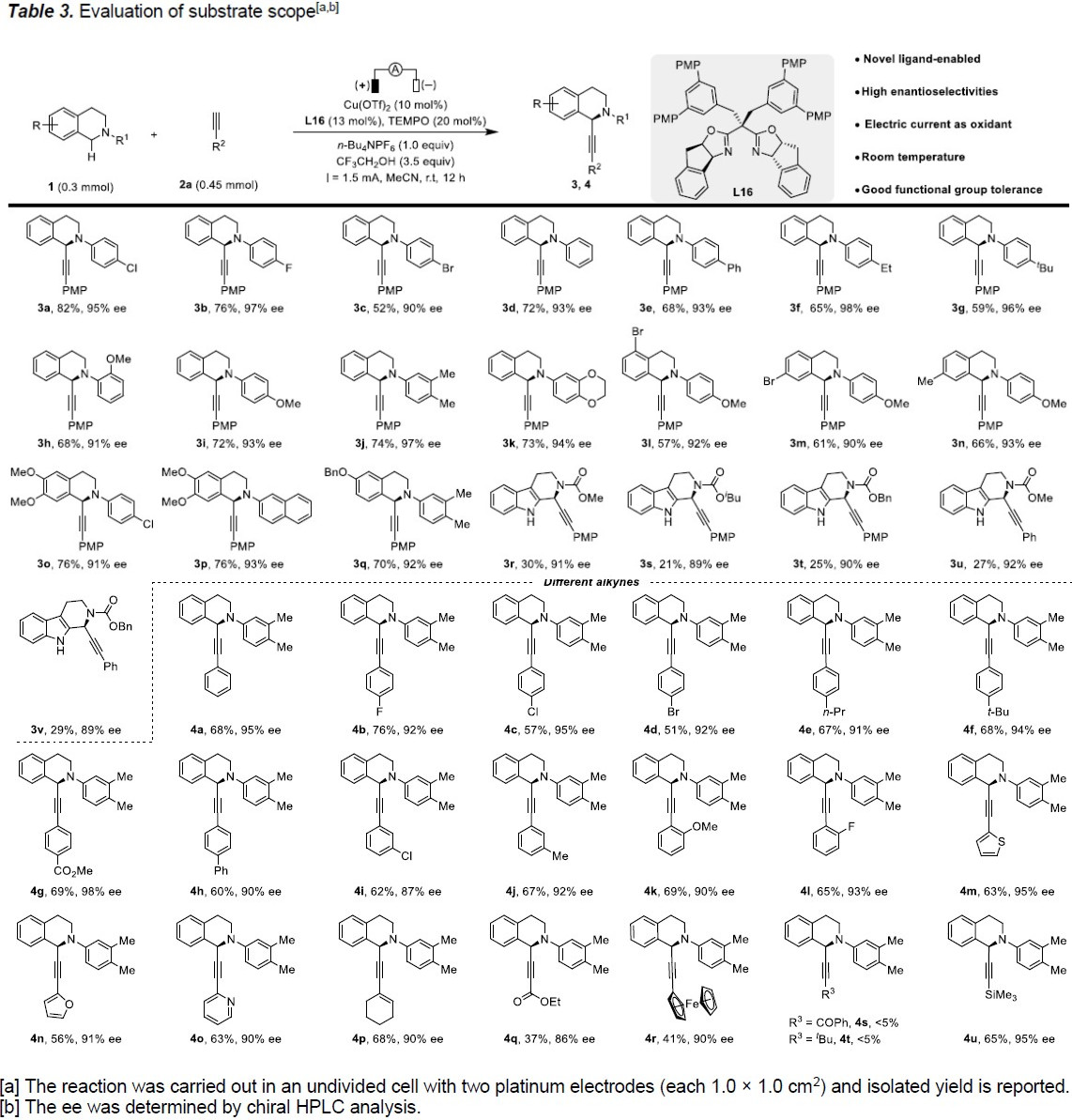
在获得上述最佳反应条件后,作者首先对THIQ底物1进行了扩展(Table 3)。反应结果表明,在标准反应条件下,在氮原子上带有苯基取代(如甲氧基、卤化物、苯基、烷基和杂环)的THIQ,均具有良好的耐受性,从而以高收率和出色的对映选择性获得相应的炔基化产物3b–3q。然而,在氮上带有酯基的THIQ底物,虽然可以获得高对映选择性的产物3r–3v,但产率却很低,可能是由于底物的高氧化电位从而降低了反应性。
紧接着,作者又对末端炔烃底物2的范围进行了研究(Table 3)。当使用苯乙炔基对位含有卤化物、烷基、苯基和酯的底物时,反应均具有良好的耐受性,从而以高收率和出色的对映选择性获得相应的产物4a–4h。同样,在标准条件下,间位或邻位取代的末端炔烃也具有相似的结果,以62-69%的收率和90-94%ee获得所需的产物4i–4l。此外,带有杂环的末端炔烃同样适合该体系,从而获得目标产物4m–4o。值得注意的是,在Cu/TEMPO共催化体系中,包括酯、烯烃、二茂铁等在内的官能团也可以被耐受,以中等收率获得相应的产物4p–4r。不幸的是,酰基和烷基取代的炔烃无法获得产物4s和4t。但甲硅烷基取代的炔烃以65%的收率和95%的ee获得所需的产物4u。
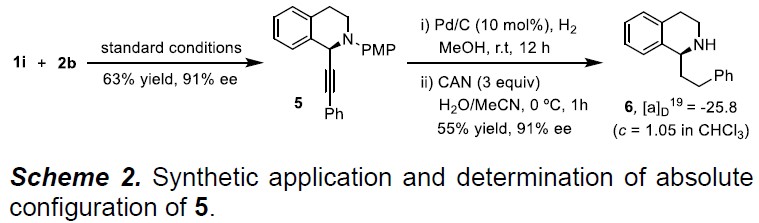
随后,作者对其应用进行了相关的研究(Scheme 2)。1-芳基乙基取代的THIQs广泛存在于生物碱中,而通过还原手性炔基化产物可以容易地合成此类化合物。如1i和2b在标准的电化学反应条件下,实现C-H炔基化反应,获得产物5,再经氢化和PMP基团的氧化裂解过程,即可获得1-苯乙基-THIQ(6),其ee为91%。
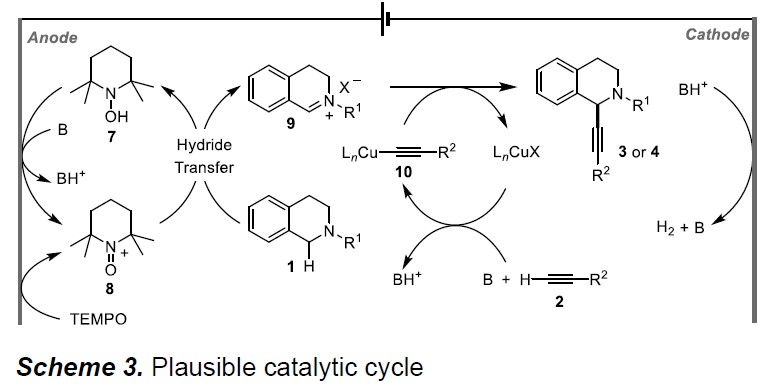
根据上述的实验和相关文献的查阅,作者提出了一种可能的反应机理(Scheme 3)。首先,TEMPO在阳极氧化形成氧铵中间体8(TEMPO +),再与1经氢转移后生成亚胺中间体9,同时形成TEMPO-H中间体7,可通过阳极继续氧化转化为中间体8,完成循环。随后,在碱性条件下,Cu(I)和炔烃2配位形成乙炔铜中间体10,再与亲电子试剂9加成形成产物3或4。活性的Cu(I)可通过铜(II)与TEMPO-H反应或阴极还原铜(II)获得。
总结
上海有机所梅天胜教授课题组报道了在Cu/TEMPO共催化下,使用新型手性双恶唑啉配体,通过电化学途径,实现环胺与末端炔烃的不对称氧化偶联反应,获得多种具有高收率和高选择性的手性C1-炔基化THIQ衍生物。此外,使用TEMPO作为助催化剂,不仅能够促进四氢异喹啉氧化成亚胺离子,同时也能够降低反应的氧化电位。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!

















No comments yet.