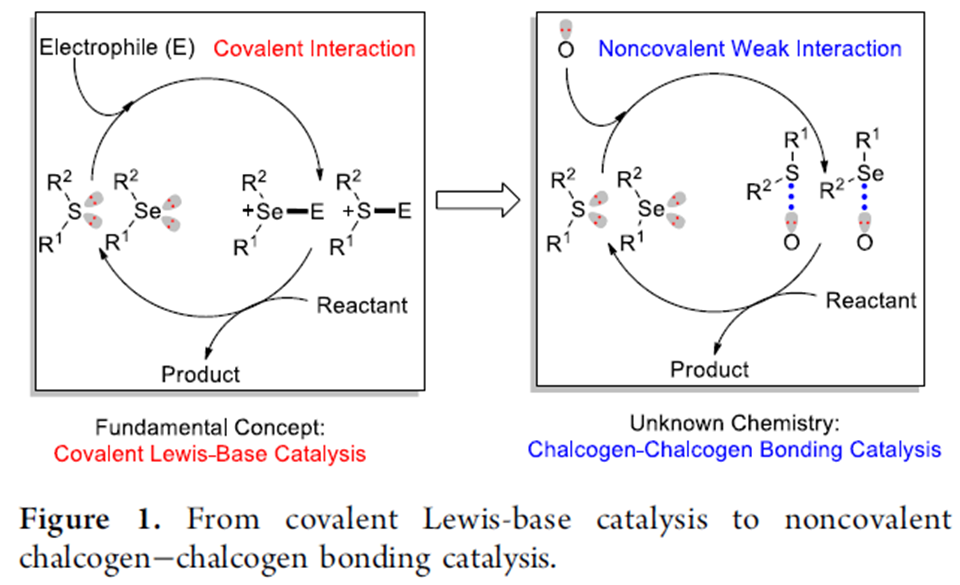
众所周知,含硫族元素的有机分子是通过与吸电子的底物发生共价键结合,从而发挥催化作用。自然,很少会有人想到硫属元素催化剂可通过非共价的激活模式来活化底物。事实上,硫属元素-硫属元素这种弱的非共价相互作用广泛存在于蛋白质和有机小分子中,且发挥着重要的作用。最近,Matile和Huber课题组发现硫属元素催化剂可以通过非共价的激活模式催化喹啉或亚胺[1]与Hantzsch酯的还原反应以及从活泼的分子中提取卤化物[2]。但硫属元素催化剂与底物之间形成的非共价键非常弱,所以利用硫属元素作为催化剂催化反应仍然面临巨大的挑战。受到生物系统分子间非共价S···O相互作用的启发,山东大学王瑶团队设想硫属元素-硫属元素相互作用可能突破硫属元素催化剂的内在局限性。在上述背景研究的基础上,山东大学王瑶团队开发了一类功能强大的硫属元素催化剂。在硫属元素催化剂催化体系下,β-酮醛和吲哚能发生环化反应,可以中等至良好的收率得到七元N-杂环化合物。相关研究成果发表于
Chalcogen−Chalcogen Bonding Catalysis Enables Assembly of Discrete Molecules
Wang, W.; Zhu, H.; Liu, S.; Zhao, Z.; Zhang, L.; Hao, J.; Wang, Y.* J. Am. Chem. Soc. 2019, 141, 9175-9179
(图片来源:J. Am. Chem. Soc.)
论文作者介绍:
论文作者:王瑶“齐鲁青年学者”特聘教授(博士生导师)
教育经历:
2002.9-2006.6,兰州大学,化学与化工学院,化学国家基地班,学士
2006.9-2012.6,兰州大学,功能有机分子化学国家重点实验室,有机化学,博士
工作经历:
2011.1-2012.12,兰州大学,优博计划选拔留任功能有机分子化学国家重点实验室
2013.1-2015.8,德国马普分子生理学研究所洪堡学者
2015.9-至今,山东大学,化学与化工学院,教授
研究方向:有机合成方法学研究、天然产物全合成以及其结构导向的化学生物学研究
论文概要:
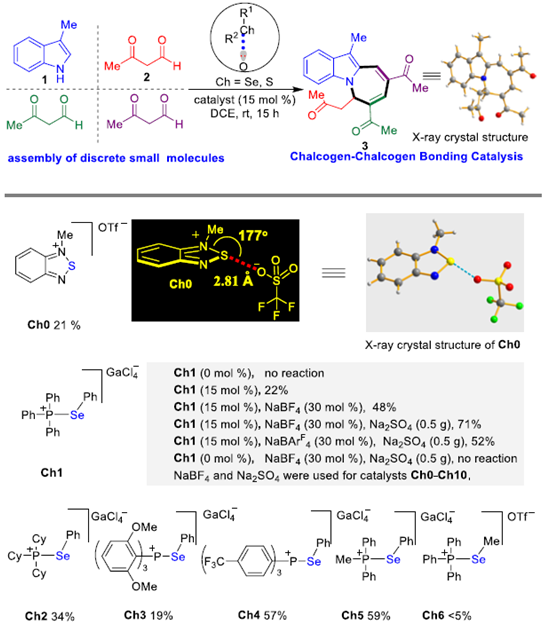
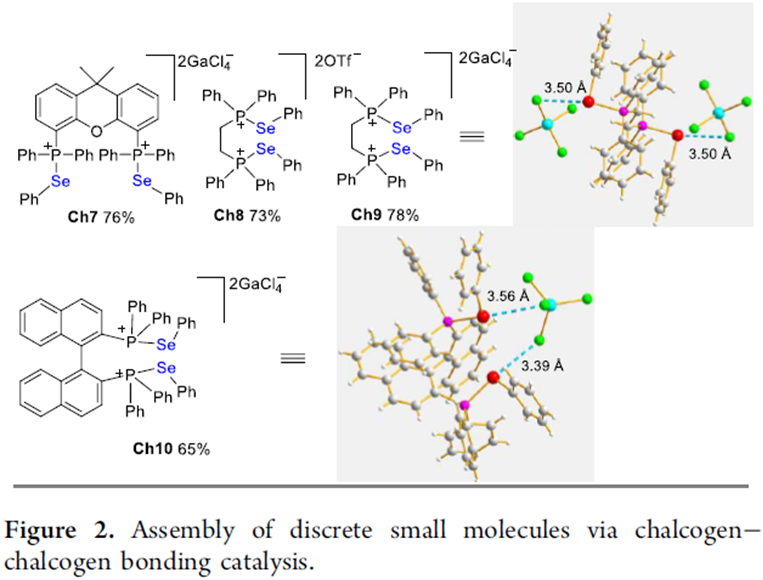
首先,作者通过化合物Ch0的单晶看出Ch0分子内存在较强S···O相互作用,而且N-S···O几乎在一条直线上,这与理想的硫属元素催化剂高度契合。因此,作者利用化合物Ch0作为硫属元素催化剂来催化吲哚和β-酮醛反应。该反应能较好的进行,能以21%的收率得到N-杂环化合物3 (Figure 2)。
(图片来源:J. Am. Chem. Soc.)
受到上述结果的鼓舞,作者通过对催化剂、添加物等反应条件进行反复筛选,确定最优的反应条件:15 mol% Ch9为催化剂,0.6-0.8 equiv NaBF4或NaBArF4以及0.5g干燥的Na2SO4为添加物,DCE为溶剂,在室温条件下反应15小时,能以78%的收率得到相应产物。同时,在最优反应条件下,各种芳基取代和杂环取代的吲哚以及各种酮醛均能较好的适应反应条件,能以中等至良好的收率得到相应产物(Table 1)。
Table 1 Substrate Scope
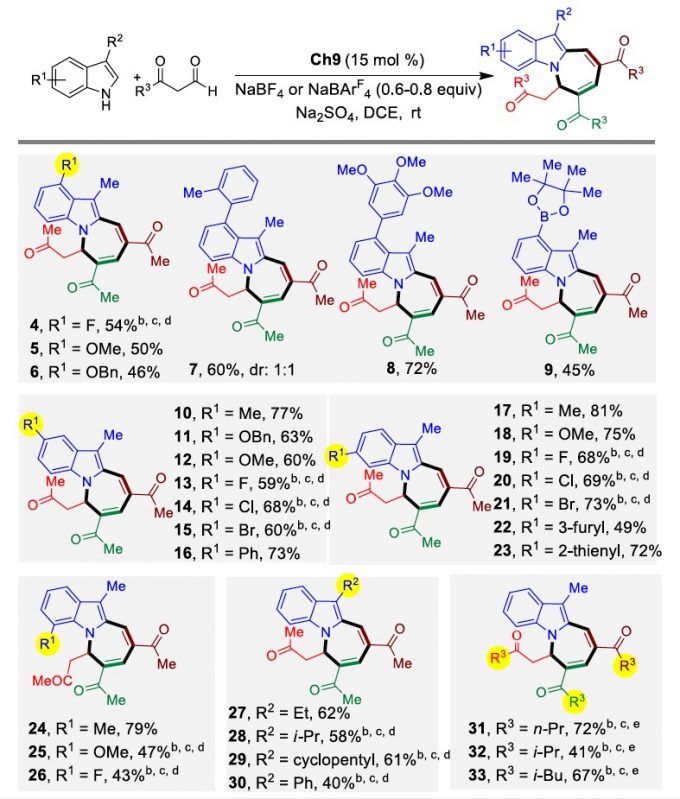
aUnless otherwise indicated, reactions were carried out with indole derivative (0.20 mmol), β-ketoaldehyde (3.0 mmol), Ch9 (15 mol %, 0.03 mmol), NaBF4 (0.12 mmol, 0.6 equiv), and Na2SO4 (0.50 g) in DCE (2.0 mL) at room temperature. The data are reported as isolated yields. b20 mol % Ch9 was used. cRun in DCM. dRun at 0 °C using NaBArF4 (0.16 mmol, 0.8 equiv). eNaBF4 (0.16 mmol, 0.8 equiv). DCE, 1,2-dichloroethane; DCM, dichloromethane.
(图片来源:J. Am. Chem. Soc.)
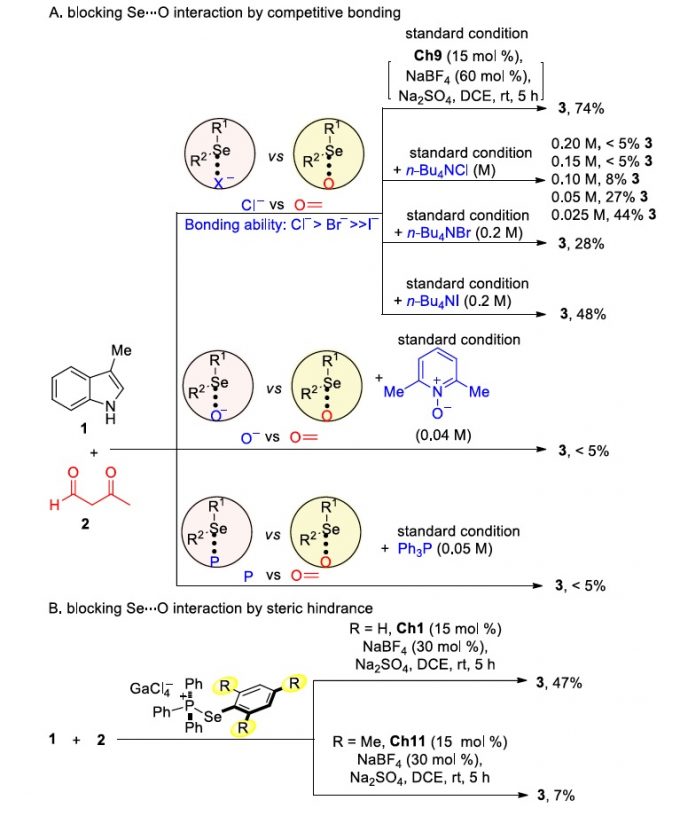
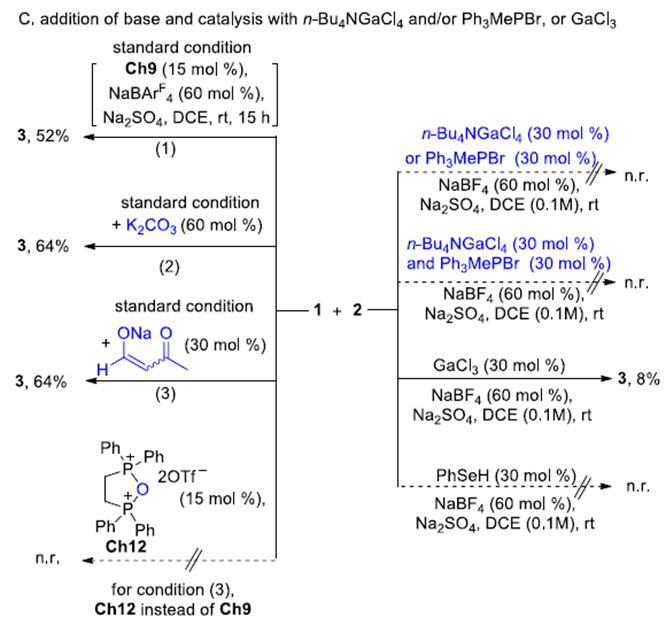
为了进一步了解硫属元素-硫属元素键之间的相互作用,作者进行了一系列对照实验(Scheme 1)。标准条件下加入2 equiv四丁基氯化胺,作者发现该环化反应的产物明显减少。随着四丁基氯化胺的浓度逐渐减低,该环化反应的产物会随之增多。若将四丁基氯化胺换成四丁基溴化胺,则该环化反应的产物也会减少,但相对四丁基氯化胺的影响相对较小。若换成四丁基碘化铵,则该环化反应产物减少的速率明显降低。此外,若加入更强的硫属元素竞争剂2,6-二甲基-吡啶-N-氧化物,该环化反应则被明显抑制。若在标准反应体系中加入50 mol%的PPh3,可以观察到非共价键Se···P相互作用且该环化反应被明显抑制(Scheme 1A)。完全相同的两个反应,一个加入催化剂Ch1,另外一个加入空间位阻相对较大的催化剂Ch11。作者发现催化剂为Ch11 的反应收率明显低于催化剂为Ch1的收率。这一结果表明Se···O相互作用易受空间因素的影响(Scheme 1B)。标准条件下,将催化剂换成n-Bu4NGaCl4、Ph3MePBr、两者一起加入以及PhSeH,该环化反应不能正常进行。若将催化剂换成GaCl3,仅能以8%的收率得到相应产物(Scheme 1C)。标准条件下,加入能中和Brønsted酸的K2CO3或3-羰基丁-1-烯-1-醇酸钠,反应能正常进行但收率未提高。若用磷酐催化剂Ch12替代Ch9,该反应不能进行。这些对照实验结果表明Se···O相互作用对该环化反应的进行起着至关重要的作用。紧接着,作者通过31P NMR监测反应的进行。结果显示催化剂Ch9和催化剂Ch10只显示一个31P信号。即使将催化剂Ch10、水和硫酸钠搅拌2小时,31P NMR显示Ch10没有分解。这些结果表明,硫属元素催化剂是稳定的,从而排除了硫属元素催化剂分解的中间体催化该环化反应的可能。
Scheme 1 Mechanistic Investigation
(图片来源:J. Am. Chem. Soc.)
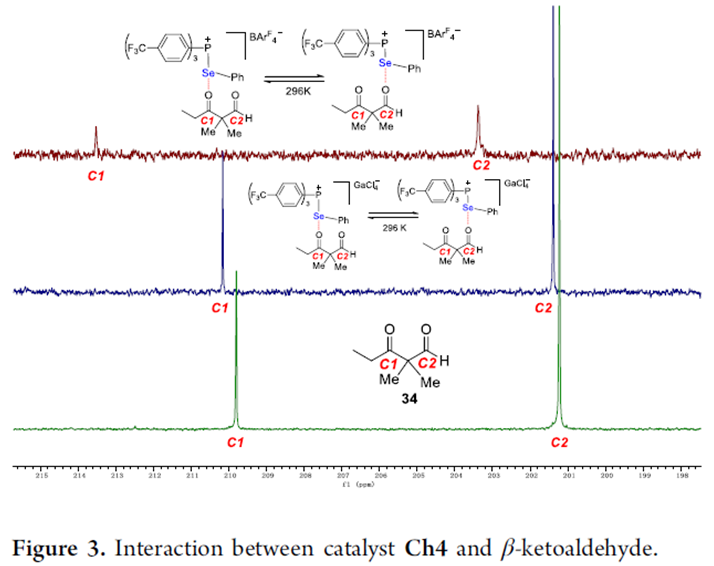
13C NMR实验显示将催化剂Ch4和β-酮醛34以1:1加入到CD2Cl2中,酮基的碳信号向高场方向移动了0.36 ppm,醛基的碳信号向高场方向移动了0.18 ppm。在上述混合物中加入NaBArF4后,酮基和醛基的碳信号分别向高场方向移动了多达3.74 ppm和2.16 ppm。同样的,在催化剂Ch9的作用下,酮基和醛基的碳信号向高场方向移动了5.53 ppm和3.37 ppm。这些实验结果进一步证明了反应中存在强烈的Se···O键相互作用(Figure 3)。
(图片来源:J. Am. Chem. Soc.)
上述实验结果显示这些硫属元素催化剂具有活化羰基的能力。因此,作者又利用该类催化剂来催化其它反应(Scheme 2)。例如:这种硫属元素催化剂可催化不饱和酮和N-烷基吲哚的反应;催化剂Ch7可催化甲基酮生成烯醇,烯醇再与双键反应能以中等的收率得到桥连N-杂环化合物;在中性条件下,硫属元素催化剂可催化弱亲核试剂3-甲基吲哚和α,β-不饱和酮发生aza-Michael反应,若想要合成更具亲核性的氮阴离子,则需要将底物换成酸性更强的吸电子取代的吲哚。
(图片来源:J. Am. Chem. Soc.)
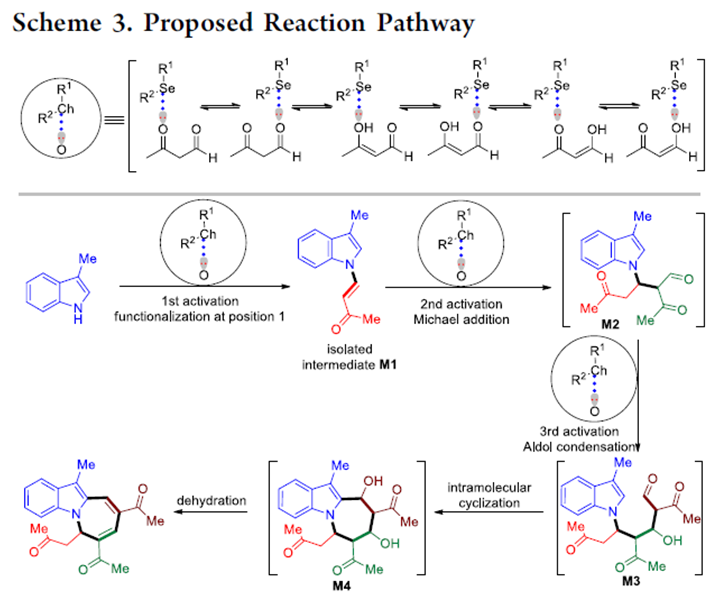
根据上述实验结果以及对药物分子和蛋白质之间非共价键S···O相互作用的观察,作者推测可能的机理(Scheme 3):首先,硫属元素催化剂通过Se···O相互作用活化β-酮醛,活化的醛酮与吲哚发生缩合反应生成的中间体M1会进一步与β-酮醛发生Michael加成反应生成中间体M2。然后,在硫属元素催化剂催化作用下,M2发生羟醛缩合反应生成稳定的带功能性基团的中间体M3。最后,中间体M3经历分子内环化过程和脱水过程生成环化产物。
(图片来源:J. Am. Chem. Soc.)
总结性评价:山东大学王瑶课题组开发了一类功能强大的硫属元素催化剂。该硫属元素催化剂可催化β-酮醛和吲哚发生环化反应,能以中等至良好的收率得到七元N-杂环化合物。此外,该硫属元素催化剂表现出的强大催化潜力和活化模式将给合成领域注入新的活力和契机。
参考文献:
- Benz, S.; López-Andarias, J.; Mareda, J.; Sakai, N.; Matile, S. Angew. Chem. Int. Ed. 2017, 56, 812. DOI: 10.1002/anie.201611019
- Wonner, P.; Vogel, L.; Düser, M.; Gomes, L.; Kniep, F.; Mallick, B.; Werz, D. B.; Huber, S. M. Angew. Chem., Int. Ed. 2017, 56, 12009. DOI: 1002/anie.201704816
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.