投稿作者 齐藩
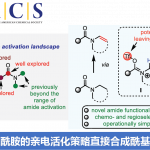
未活化的碳氢键官能化反应已经成为上个世纪有机化学的挑战之一,现在已成为化学反应研究的圣杯。多样复杂的天然产物结构为探索碳氢键官能化反应的适用性提供了更有挑战性的分子背景[1]。
Rapid Construction of a Benzo-FusedIndoxamycin Core Enabled by Site-Selective C-H Functionalizations
Bedell, T. A.; Hone, G. A.; Valette, D.; Yu, J. Q.; Davies, H. M.; Sorensen, E. J
Angew. Chem. Int. Ed. 2016,55 (29), 8270-4. DOI: 10.1002/anie.201602024.
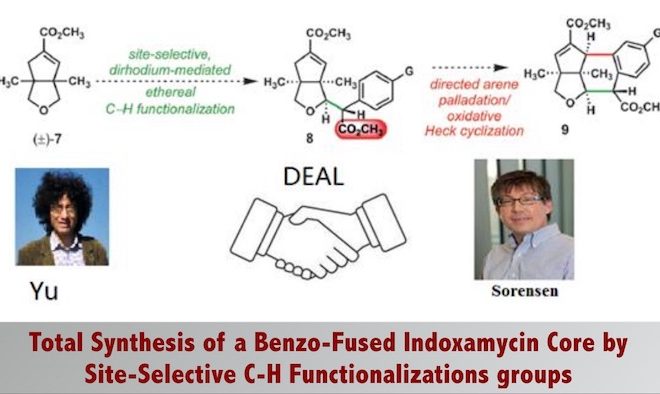
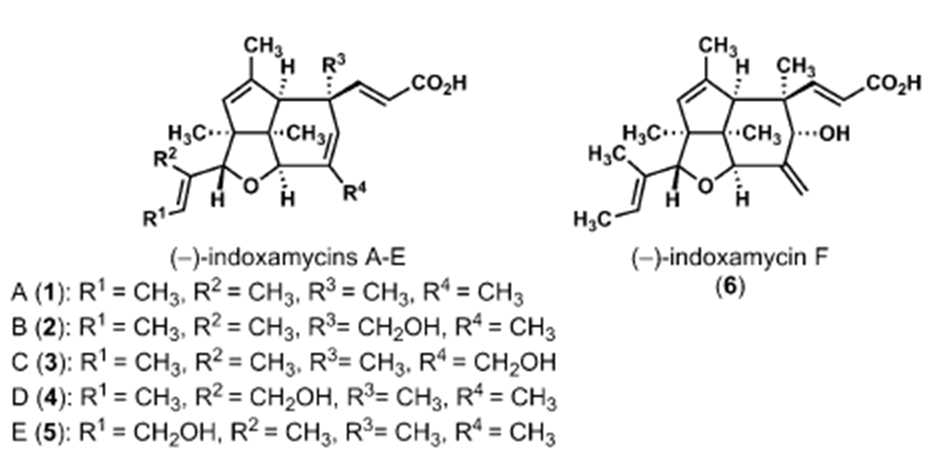
Indoxamycin从一种海洋放射菌分离得到,主体结构为6,5, 5三环顺式包围的结构[2],这篇文章从单环结构通过碳氢键活化去构建这一海洋天然的主体结构。这一天然产物的合成又一次验证了C-H官能化反应在复杂结构的合成中的价值,这一工作由C-H活化领域最活跃的化学家余金权教授与著名合成化学家Sorensen教授合作完成。
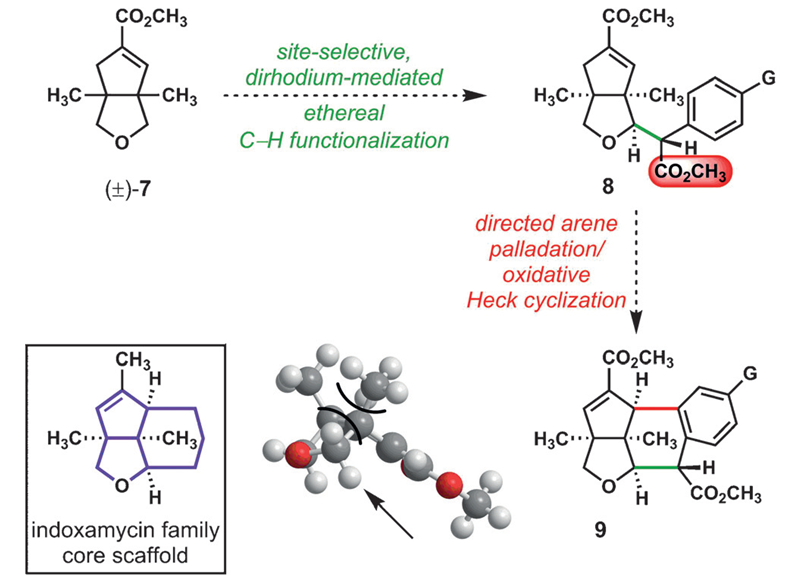
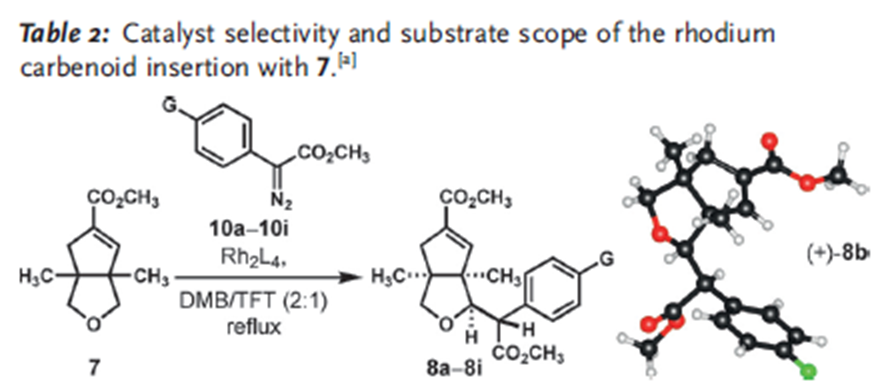
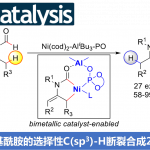
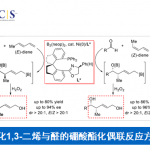
逆合成分析:先通过铑催化重氮芳基乙酸酯的卡宾C-H键插入反应将两个片段链接起来[3],然后通过钯催化的烯烃化反应[4],立体选择性地构建了Indoxamycin Core。
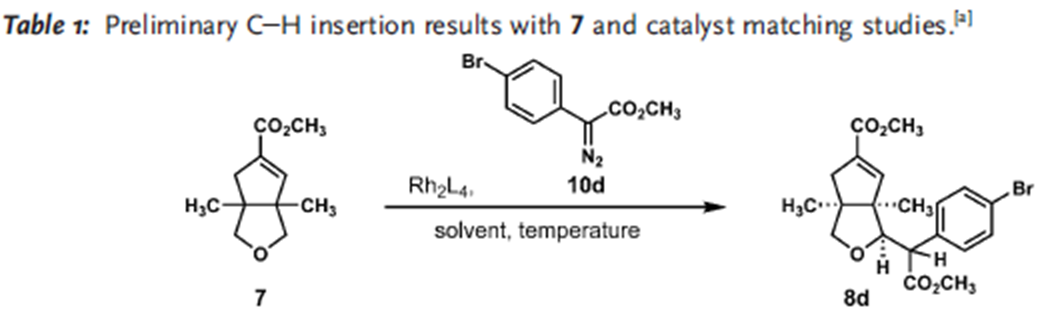
这个反应有至少有两个选择性的问题需要控制,其一,四氢呋喃是不对称的,如何控制位置的选择性。其二,这一反应的立体性问题。首先,这一方法中对不同的碳氢键化学环境所表现出的反应速率有很大差别,其中在这一结构中,四氢呋喃α位碳氢键反应活性最高,反应速率也最快,故而选择性活化这个位置的碳氢键。第二,四氢呋喃是不对称的,这里选择在双环[3.3.0]结构中处在凹面的位置,即靠近酯基远离桥头碳甲基的位置。第三,通过动力学拆分,使用催化剂Rh2[(s)-PTAD]4实现了立体选择性合成,d.r. >20:1。
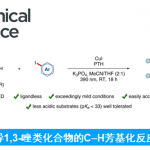
主要考察了重氮苯乙酸甲酯芳基对位取代的适用性,表明卤素(F, Cl, Br, I)都能很好地适应这一反应,常见吸电子基团并不适用,但是三氟甲基和酯基能够有效参与反应。
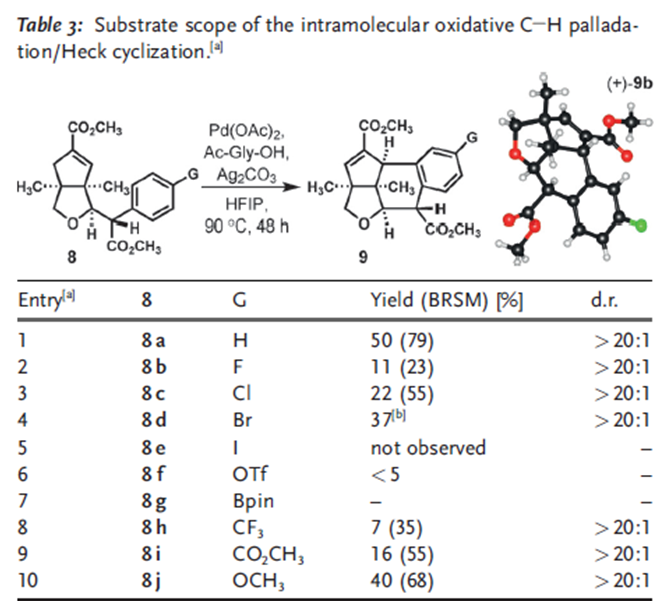
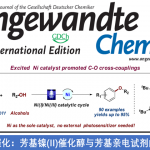
这一钯催化的弱配位的酯基引导的C-H键Heck环化反应在这一复杂天然产物的合成中,存在几个挑战,首先是呋喃的氧原子和酯基可能对钯催化剂的配位;其二复杂天然产物中,空间相对拥挤,这时钯配合的催化剂要发生高效的C-H键Heck环化反应难度很大;其三,化合物7片段在8中几何构型不利于这一转化的发生。
化合物8a反应产率在50%,其他取代基的化合物产率都很低,其中8d的反应产物中容易得到无法分离的脱溴产物,9a/9d为1.6:1,I,OTf,Bpin取代的化合物8几乎不能得到目标产物,其中8e完全被还原成8a,8f和8g不参与反应但是原料可以回收。这一转化的立体化学控制可能与化合物中7的片段的立体结构有关系。
参考文献
- a) K. C. Nicolaou, S. A. Snyder, Classics in Total Synthesis II: More Targets, Strategies, Methods, 1st ed., Wiley-VCH, Weinheim, 2003. b) R. A. Shenvi, D. P. O’Malley, P. S. Baran, Chem. Res.2009, 42, 530-541.DOI:10.1021/ar800182r.3) K. C. Nicolaou, J. S. Chen, Classics in Total Synthesis III: Further Targets, Strategies, and Methods, 1st ed., Wiley-VCH, Weinheim, 2011.
- Sato, F. Iwata, T. Mukai, S. Yamada, J. Takeo, A. Abe, H. Kawahara, J. Org. Chem.2009, 74, 5502-5509.DOI:10.1021/jo900667j.
- M. L. Davies, T. Hansen, M. R. Churchill, J. Am. Chem. Soc.2000, 122, 3063-3070. DOI:10.1021/ja994136c.
- a) X. Chen, K. M. Engle, D.-H. Wang, J.-Q. Yu, Chem. Int. Ed.2009, 48, 5094–5115;DOI:10.1002/anie.200806273. b) R. Giri, B.-F. Shi, K. M. Engle, N. Maugel, J.-Q. Yu,Chem. Soc. Rev.2009, 38, 3242-3272; DOI: 10.1039/B816707A. c) K. M. Engle, D.-H. Wang, J.-Q. Yu, J. Am. Chem. Soc. 2010, 132, 14137-14151;DOI: 10.1021/ja105044s. d) K. M. Engle, T.-S. Mei, M. Wasa, J.-Q. Yu, Acc. Chem. Res.2012, 45, 788-802;DOI: 10.1021/ar200185g.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



















No comments yet.