本文作者:Sunny华
引言
高血压,即动脉血压持续偏高,是最常见的慢性疾病之一,也是心脑血管疾病最主要的危险因素。根据世界卫生组织2019年的数据显示,全球估计共有数十亿人患有高血压,其中绝大多数患者生活在低收入和中等收入国家,更为严峻的是尽管高血压是全球人类早逝的一个主要原因,但只有不到五分之一高血压患者的问题能得到控制。[1]
图 1 卫生专业人员测量血压是高血压疾病诊断的最简单方式
由于大多数高血压患者身体并无警示信号或症状,高血压也常被称为“沉默的杀手”,然而国内外实践均证实:高血压是可以预防和控制的疾病。秉持“预防为主,防治结合”的方针,通过生活习惯的改变和抗高血压药物的介入,高血压通常可以得到有效控制。临床上用于控制血压和治疗高血压的药物统称为降压药(抗高血压药)。在种类繁多的降压药中,卡托普利(Captopril)是一种血管紧张素转化酶抑制剂(ACE inhibitor,ACEI),被应用于治疗高血压和某些类型的充血性心力衰竭。作为第一种ACEI类药物,由于其新的作用机制和革命性的开发过程,卡托普利被认为是药物治疗上的一个突破。
蛇毒中的“降压”分子
卡托普利1975年由美国施贵宝公司(现百时美施贵宝公司)的研究人员开发并于次年2月申请专利保护,它也是最早通过基于结构的药物设计(structure-based drug design)这一革命性理念而开发的药物之一。更有意思的是,卡托普利实际是基于美洲洞蛇毒液中的某种多肽末端结构的“构效关系”开发而来。
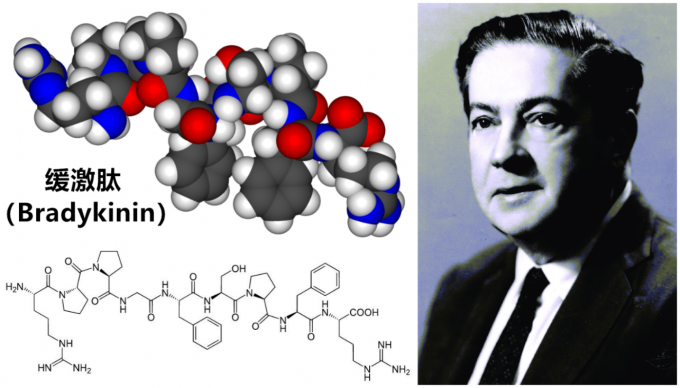
故事要从1939年讲起,当时巴西药理学家Maurício Rocha e Silva正在对与毒蛇咬伤相关的循环休克以及酶进行研究,1948年他与同事对注射美洲洞蛇毒液后的实验动物的血浆成分进行研究,这种毒液经常被巴西土著部落涂在箭头上用来增强武器杀伤力。在这些实验动物血浆中,研究人员发现了一种全新的多肽并根据希腊语将其命名为“bradykinin”,即血管舒缓激肽(缓激肽)。进一步研究还发现,缓激肽通过引起血管扩张进而导致血压降低。几年后,巴西另一位药理学家Sérgio Ferreira发现了蛇毒中另一种可以更长时间和更大程度上引起血管扩张和血压降低的分子,他将其命名为缓激肽增强因子(bradykinin potentiating factor,BPF),这也为研发新型治疗高血压的药物提供了新思路。
图2 缓激肽的结构及其发现者Maurício Rocha e Silva
血压调节机制的发现
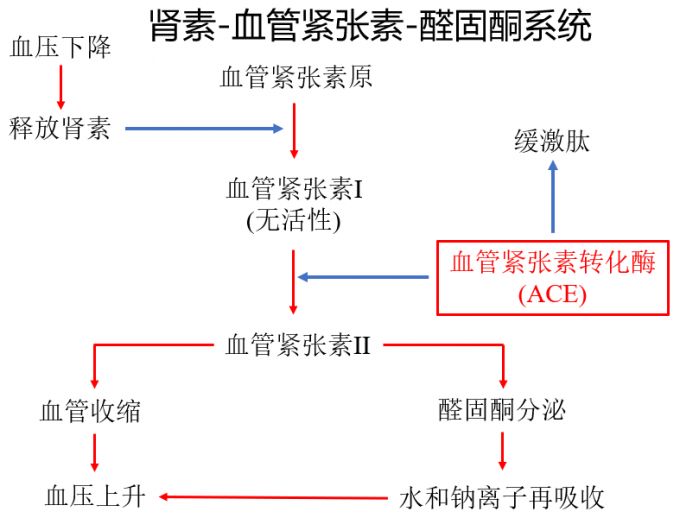
时间一晃来到了1967年,英国皇家外科学院的研究人员Kevin K. F. Ng发现人体血液中存在两种分子似乎发挥着控制血压的作用。当肾脏感测到血压降低时,特定的细胞开始释放一种被称为肾素(renin)的物质,它再通过一系列生理过程产生另外两种分别被称为血管紧张素I和血管紧张素II的分子,前者基本没有生物学活性,只有经某种特殊的酶转化形成血管紧张素II后才能发挥作用。血管紧张素II具有高效的收缩血管作用,从而使血压升高;此外,血管紧张素II还能刺激肾上腺皮质分泌醛固酮,醛固酮能促进肾脏对水和钠离子的再吸收,继而增加体液容量,升高血压。后来,这种调节机制被称作“肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system, RAAS)”。
图3 肾素-血管紧张素-醛固酮系统示意图
更有意思的是,英国和巴西的研究人员后来合作发现:血管紧张素I转化为血管紧张素II这一过程与缓激肽的失活是由相同的酶介导的。这意味着如果能够确定该种酶的种类并对其活性进行抑制即可减少血管紧张素I转化为血管紧张素II,同时抑制缓激肽降解,从而实现舒张血管、降低血压的作用。人类对这种名为血管紧张素转化酶(angiotensin-converting enzyme, ACE)作用机制的揭示成为高血压治疗的重要突破。
卡托普利的艰难研发
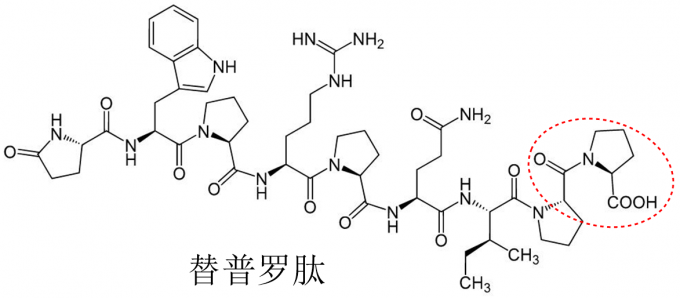
血管紧张素转化酶作用的揭示为一类名为血管紧张素转化酶抑制剂(ACE inhibitor,ACEI)药物的开发提供可能。作为第一种ACEI类药物,卡托普利的研发过程还是得从蛇毒讲起。前文已经提到,巴西药理学家Sérgio Ferreira曾发现蛇毒中存在一种缓激肽增强因子BPF,它通过抑制缓激肽降解酶来增强缓激肽的作用,当BPF作用于血管紧张素转化酶ACE后表现出有效的抑制作用。而蛇毒中这种神秘的BPF被Ferreira等人证实其实是一种由九种氨基酸组成的九肽化合物——替普罗肽(Teprotide),它具有较长的半衰期和优秀的降压效果。然而,这种多肽化合物价格极其昂贵并且不能通过口服的方式给药,因此研究人员不得不尝试对其结构进行修饰和改造。
图4 替普罗肽(Teprotide)的化学结构
显然,这项艰巨且复杂的工作不能仅仅依靠部分科研人员的努力,还需要大型制药公司进行庞大人力和物力的投入。彼时,另一位因研究降压药物而颇具知名度的科学家John R. Vane成为推进这项工作的关键人物。Vane除了英国皇家外科学院药理学教授身份外,他还是 美国施贵宝公司(现百时美施贵宝公司)的顾问,正是Vane基于ACE能够调节血压的理论说服了施贵宝公司的研究人员,施贵宝公司开始涉足心血管药物的研发。尽管如此,基于替普罗肽的新型降压药物研发依然困难重重,研究人员合成数千种化合物但无一例外都没能表现出预期的结果。山穷水尽之时, 施贵宝公司三名研究员Miguel Ondetti、Bernard Rubin 和David Cushman重点关注了替普罗肽各个结构片段的作用并由此发现真正发挥作用的结构是末端的脯氨酸(proline)部分(图4红色虚框部分),其余庞大的部分都是为了更好与ACE酶进行结合。于是问题似乎明朗起来:只需要保留末端脯氨酸部分,对左侧侧链部分进行适当改变即可获得预期的结果。然而,选择何种结构作为侧链再次困扰了研究人员。
图5 John R. Vane后来因“发现前列腺素及其相关的生物活性物质”荣获1982年诺贝尔生理学或医学奖(图片来源于www.nobelprize.org)
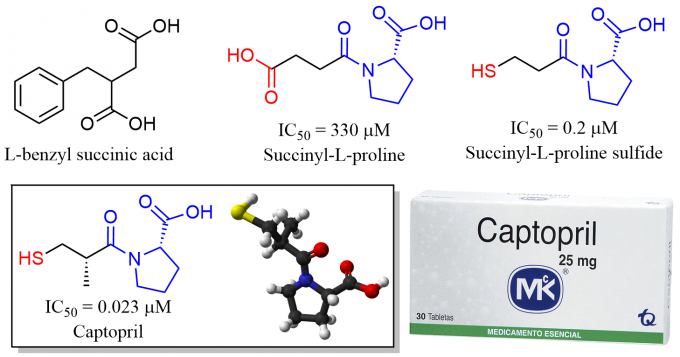
既然替普罗肽复杂的侧链结构是为了与ACE更好地结合,研究人员自然想到需要从ACE自身结构出发,然而遗憾的是当时人们对ACE的结构一无所知(直到2003年ACE的结构才被解析)仅仅发现它与一种已知结构的名为羧肽酶A(Carboxypeptidase A)的生化机理相似。恰好那时某篇文献中报道L-苄基琥珀酸(L-benzyl succinic acid)可与羧肽酶A紧密结合并且抑制其酶活性。受此启发,研究人员需要设计一种兼具L-苄基琥珀酸结合能力和脯氨酸抑制ACE活性能力的化合物。他们首先想到了琥珀酰基-L-脯氨酸(Succinyl-L-proline),虽然该化合物具有一定的ACE抑制能力但还不足以用作药物,将其进一步衍生为巯基时活性得到了数千倍的提升,随后研究人员又对侧链的长度、取代基以及手性异构体进行了细致的优化并最终确定1-[(2S)-2-甲基-3-巯基-1-氧代丙基]-L-脯氨酸具有最佳的药理活性。
图6 卡托普利开发过程中代表性的活性化合物
ACEI药物的后起之秀
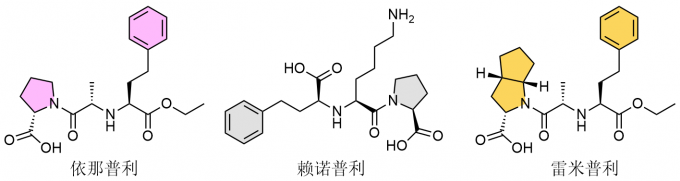
筛选出卡托普利的结构后,它又历经坎坷的临床试验最终在1981年6月获得美国食品药品监督管理局(FDA)认证获得上市许可,随后的几年中卡托普利一直保持较高的销量,1992年时的销售额一度超过16亿美元。作为第一种ACEI类药物,由于其新的作用机制和革命性的开发过程,卡托普利被认为是药物治疗上的一个突破,但它还是存在着不可忽视的副作用,特别是造成咳嗽、皮疹和味觉紊乱等。此时,基于卡托普利结构开发的新型ACEI药物应运而生,例如依那普利(enalapril)、赖诺普利(lisinopril)和雷米普利(ramipril)等,这些新型药物凭借更好的疗效和更低的副作用很快取代了卡托普利的主导地位,成为ACEI类药物的后起之秀,时至今日依然是降压的一线药物。
图7 代表性的新型ACEI类药物
结束语
卡托普利为治疗高血压开辟了新的途径,它的成功不仅证明了ACE概念的正确性,也是基于结构的药物设计(structure-based drug design)的典范,并为后来ACEI药物的研发提供蓝本。事实上,药物设计是一门技术含量超高的学科,不仅需要研究人员深厚的专业知识背景,还需要多学科的交叉融合才能将想法变为现实药物。近年来,随着多学科和交叉学科的迅猛发展,特别是计算机技术的突飞猛进,计算机辅助药物设计(Computer-Aided Drug Design,CADD)方法在药物研发中不断崭露头角,为新型药物的研发注入新的活力,未来定会在药物研发过程中大放异彩,也会有更多类似于卡托普利的药物诞生。


























No comments yet.