背景:
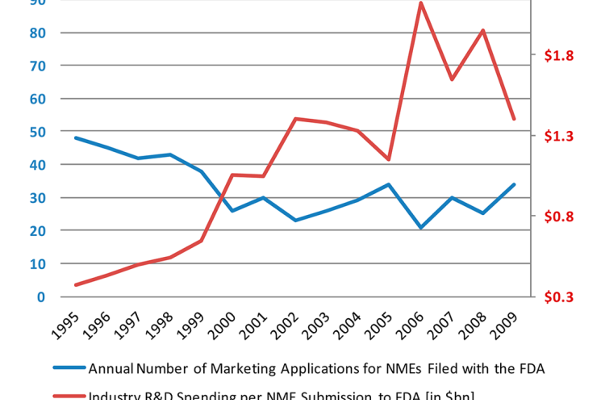
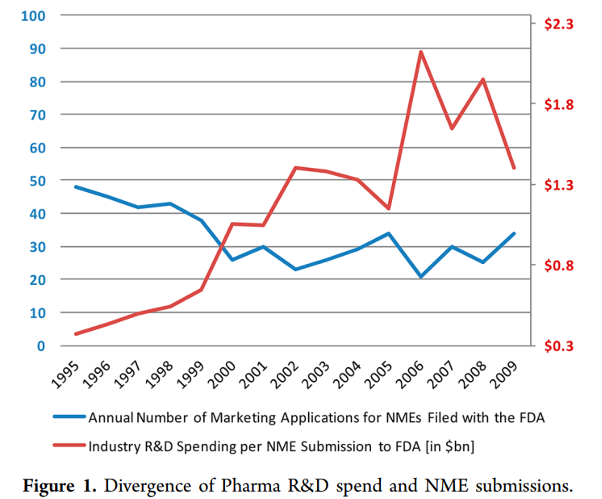
尽管制药通常被认为是一个“抗衰退”行业,近年来,大型制药公司也同样受到全球降速的不利影响,一个创新药的上市需要相当多的研发投入,研究型制药公司全球的研究与开发费用在过去的25年时间里面(1985年~2009)从41亿美金急剧增加至458亿美金。每向FDA递交一个NME,其平均花费从1995年的3亿美元逐渐增加至2009年的13亿美元。
制药公司开发和申请过程花费的巨大差异—生产成本已经在过去的10年间增长了20%。因此,为了保持竞争力和活力,制药公司开始通过模式化工艺开发、生产的体系和流程来降低生产成本。制药工艺的化学生产,已经从过去的预留一定产能和库存来确保每一个新订单的时间节点(Timeline)的传统模式发生转变,现在,一个组织必须有能力完成生产的同时第一时间形成文件系统,并且以较低的人力资源按时交付任务。要求一个企业有持续的工艺理解和开发能力,包括提高工艺从研究体系到生产车间的技术转移效率,增加过程分析技术,引入QbD理念,在API开发流程中形成一套设计生产能力系统。
API工艺设计开发应具有一定的灵活性,在早期开发阶段,公司层面希望通过设计一个稳健的,可靠的以及经济的生产工艺加速API的开发进程,以最小的变更,高效地转移到生产部门,这些因素间需要尽量平衡,避免早期的过度开发。达到以上目标,研究开发人员对于“良好生产工艺的8个原则”的理解和意识就显得尤为重要。
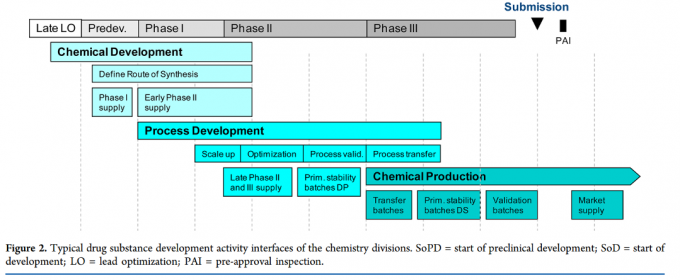
一旦一个新分子实体满足了生物学和理化性质的评估后,作为PCC分子将被转移至后续的成药性开发阶段,进行kilo-scale 合成。快速,安全,质量可控以及经济几要素将被重点关注。该阶段设计开发一个经济、可放大的路线需要多学科跨部门的合作,包括工艺化学,分析化学,技术外包,工艺工程,EHS,法规符合性,以及放大部门(kilo-lab和pilot plant)。通常包括以下三个阶段:化学开发,工艺开发,化学生产。
化学开发的目标是首先保证毒理研究和药学研究用API的供应,以及临床一期样品,同时设计一个可放大,安全,稳健和经济的合成路线,并确保操作自由度(Freedom To Operate)。在临床一期和二期早期阶段,转移到工艺开发阶段,评估其可放大性并进一步优化转移过来的工艺,如有必要甚至可以开发一个新的工艺,然后验证,并在临床三期转移至生产阶段。生产阶段支持更大规模的生产活动,进行转移工艺生产以确认工艺开发阶段转移的过程,进行原料药稳定性批次放样,生产工艺验证批,上市后进行商业化生产。
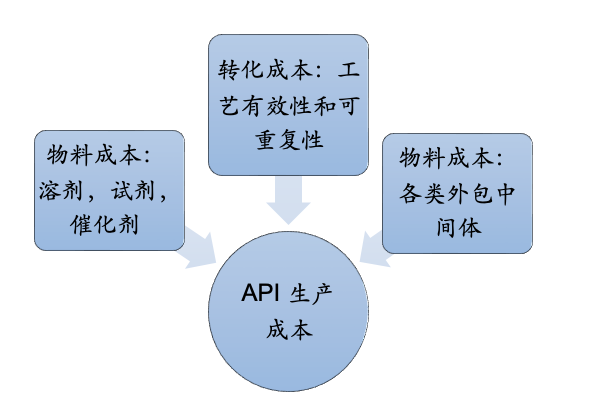
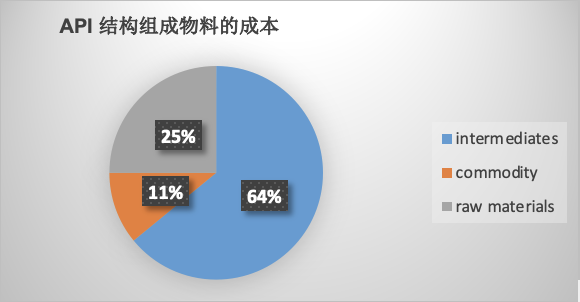
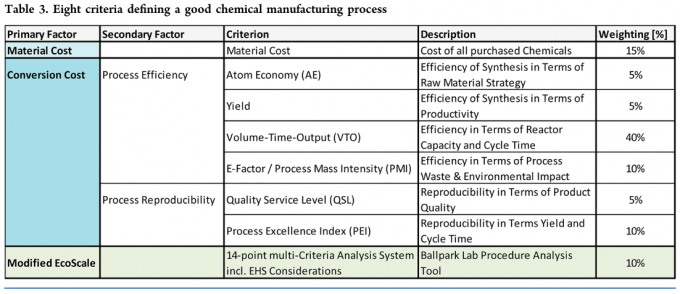
由于工艺转移过程涉及到多个部门,不同的阶段不同的部门考虑的角度不同,因此比较不同合成路线是具有挑战性的。但是生产工艺的质量是可以用对商业成本的影响来量化的,比如一个API的总的生产成本,一个涉及使用内部和外部多功能车间的多步骤的API生产过程,包括两个部分:
API生产成本= 物料成本+转化成本 (1)
物料成本:所有购买的化学品(原料,外购中间体,试剂,溶剂,催化剂)
转化成本:工艺有效性和工艺可重复性。
8个原则不建议在所有开发阶段都使用,他是一个有效的工具来讨论目前工艺的质量,以及后续开发的一个方向,评估一个化学过程需要一个全面的方法而不是仅仅依靠一个充分的参数。
原则1:物料成本
物料成本取决于需求规模,外包中间体水平,物料的供应等情况,同时如果原料和中间体用于GMP步骤,需要合规部门的参与,对供应商的要求相应提高,将导致物料成本的提高,选择一个廉价,商品化的原料对于设计路线很关键。
原则2:原子经济性(AE)
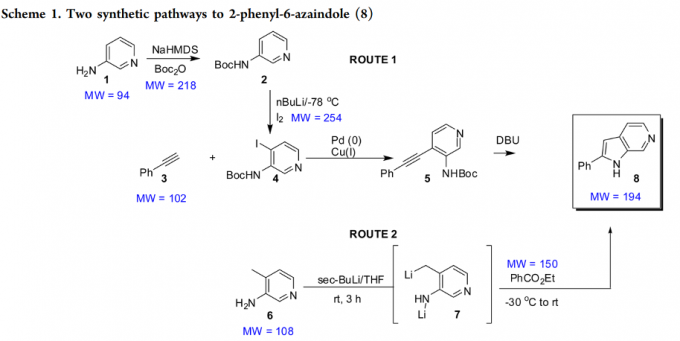
定义:产品的分子量与所有投入原料分子量之和的商,举例如下:
路线1:AE=194/(94 + 218 + 254 + 102) = 24%
路线2:AE= [194/(108 + 150)] =75%
原汁经济性的预期范围: 70-90%
原则3:收率
反应收率低,意味着副产物的水平和相对含量高,有可能随着下游的工艺步骤传递至API, 可能存在潜在杂质未检出的风险。从监管角度考虑,引出的问题是未识别的杂质命运,尤其是基因毒性杂质的监测,因为合成路线的设计中避免基因毒性杂质越来越重要。通常100%的收率描述为定量,90%以上为优秀,80%以上为非常好,70%为良好,50%为一般(fair),40%以下为不好,一个工艺化学家对收率的目标设置应不低于80%。
如下举例:一个三步骤的反应过程,每步骤80%的收率,线性路线的总收率为51%,汇聚式路线的总收率为64%,因此设计路线时应尽量考虑汇聚式路线,以期提高反应总收率。
定义:单个步骤输出每公斤产品所用釜体积之和与时间的乘积。
如果结果<1,则说明该工艺可接受,否则应视为该工艺需要进一步的优化,通常来说分离和干燥过程不纳入VTO分析,如果二者为限速步骤,那么应在结晶工艺开发中进行优化以避免分离延时情况发生。
举例说明:某多功能车间,一步化学反应需要用到两个反应釜,每个反应釜体积为3m3,第一个反应釜使用80%釜体积,第二个反应釜使用60%釜体积,每批次24小时输出产品250kg,分离和干燥在24小时内完成,该步骤VTO结果按照如下公式计算为0.58 m3 h/kg。
假定某100 m3 多功能车间,年度运营费用2千万美元,运行330天,每天24小时运转,60%的产能,每小时单体成本则为 2000w/(100*330*24*60%)=42美元/ m3 h;
0.58 m3 h/Kg *42美元/ m3 h = 24美元/Kg;
24美元/Kg*250Kg/batch = 6000美元/batch,即每批250kg产品的VTO成本为6000美元。
原则5:环境因子(E-factor)/工艺质量强度(PMI)
二者定义均以产出产品质量计,不同之处在于环境因子考虑的是产出废弃物的总质量占比,工艺质量强度考虑的是总投入质量占比。计算E-factor或者PMI时,包括后处理所用的溶剂,二者均没有考虑溶剂的回收和催化剂的再利用,E-factor的计算没有考虑到试剂制备(如:nBuLi)的过程所产生的影响。尽管没有考虑到试剂自身的性质和环境危害,二者同样不失为一个化学过程对环境影响的指示。
项目复杂程度变化很大,很难定义一个可接受的E-Factor/PMI 范围,10-40 区间通常认为是可接受的。
原则6:质量服务水平(Quality Service Level/QSL)
为了更好的理解工艺的可重复性和稳健性,定义四个质量水平来量化对于一个给定的化学反应步骤的QSL
举例说明:假设一个化学反应进行了15批次生产
- 根据主批记录生产11批次合格产品(>98%),归类为 Q1,0 失误点
- 2批次没有达到预期转化率,需要重新加工来满足预期标准>98%,2个Q3事件,每批次5 失误点
- 还有另外2批次因为非预期副反应的发生而被销毁,导致2个Q4事件,每批次1失误点
此例中,QSL =[15 – (2 × 0.5 + 2×1)]/15 = 80%。因此可知一个越发稳健或者可重复的工艺,其QSL水平应越高。通常对于给定的化学反应步骤,一个QSL水平在98%-100%之间被认为是可接受的。
原则7:工艺优异指数(Process Excellence Index/PEI)
PEI是工艺可重复性和稳健性指标尤其适用的一个工具,是工艺性能的指示,用于评价多种操作的收率和周转时间的性能,比如,反应、离心、干燥,或者其他任何工艺相关的操作。
以周转时间PEI举例说明:一步化学反应的5个批次周转时间分别为 36,32,40,37和 30 h,则平均周转时间为 (36 + 32 + 40 + 37 + 30)/5 = 35 h,周转时间中位数是36 h,最好的周转时间是30 h。 预期的周转时间水平为(36 + 30)/2 = 33 h,因此周转时间PEI为33/35 = 94%。对于商业化生产工艺来说,PEI收率和PEI周转时间目标区间在98%~100%。
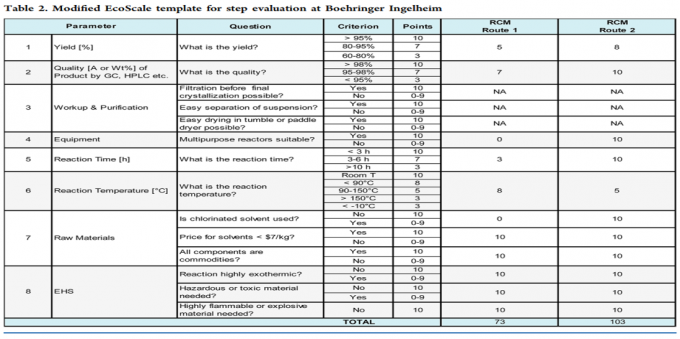
原则8:调节的Ecoscale
Ecoscale 是基于经济性和生态性选择有机制备方法的半定量的工具,不是一个单一的标准,而是结合上述7个标准以及EHS之后简化的多角度分析,分析过程可参见下表:
总结:
- VTO 标准是最有利的,并且当评估商业化的合成路线时,主要使用该指标
- 物料成本和收率同样重要,环保方面也越来越受到监管的重视
- 应通过标准的选择性应用,数据驱动来对大部分的路线进行评估选择
- 下表为总结的8个原则在良好生产工艺过程中所占权重
参考文献:Rolf Dach, Jinhua J. Song, Frank Roschangar, Wendelin Samstag, Chris H. Senanayake. Org. Process Res. Dev. 2012, 16, 1697. doi: 10.1021/op300144g




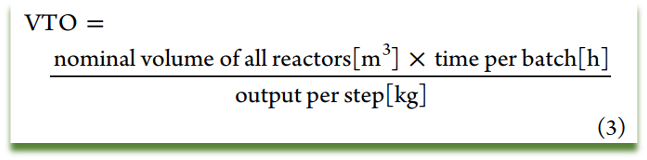
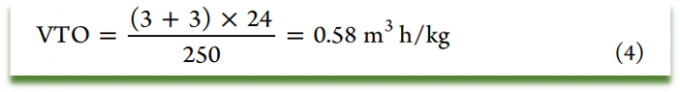

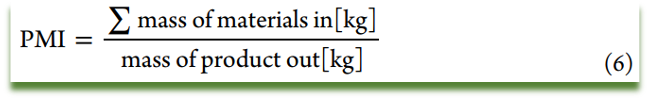


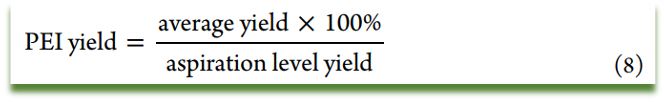


















No comments yet.