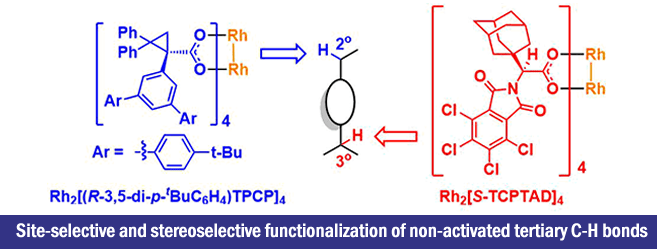
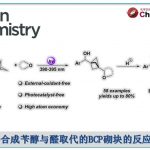
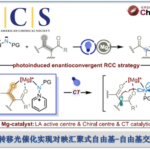
2017年、埃默里大学・Huw M. L. Davies课题组使用独自设计的手性双核铑催化剂,成功开发出了3级C-H键的位置·立体选择性的卡宾插入反应。
”Site-selective and stereoselective functionalization of non-activated tertiary C-H bonds”
Liao, K.; Pickel, T. C.; Boyarskikh, V.; Becsa, J.; Musav, D. G.; Davies, H. M. L.* Nature 2017, 551, 609–613. doi:10.1038/nature24641
课题设定
惰性C-H键的直接活化是近年来比较火的研究课题之一,并且在最近的几年中获得了显著地发展。但是位置选择性的控制还是一个难题,目前来说主要还是以(1)配有导向基团的底物 (2) 不能自内具有高反应性的C-H键的底物 (3) 只在特定的C-H键上优先进行反应的底物 作为对象,也就是说,主要停留在以选择底物来产生选择性的阶段。
课题解决方法
Davies等人在2016年报道了、二级C-H键的位置选择性以及立体选择性C-H插入反应[1]、而作为该研究的后续,又报道了3级C-H键的立体选择性修饰反应(标题图)。这两篇论文的亮点在于可以根据催化剂改变反应点。此外,对于含有烯丙基位C-H键或者苄基C-H键的化合物,C-H插入反应也能选择性的发生在3级C-H键上,并且是立体选择的进行反应,因此预计该方法可以运用于Late-Stage Functionalization上。
主张的有效性验证
①催化剂的筛选与反应条件的最优化
用各种铑催化剂评价了α-芳基-重氮酯与2-甲基戊烷的C-H插入反应的选择性。如下图所示,选择性取决于催化剂的种类,存在很大差异,含有四氯邻苯二甲酰亚胺配体的催化剂,选择性比较高、尤其是在使用Rh2[S-TCPTAD]4催化剂的情况下可以实现高位置·对映选择性C-H插入反应(79% ee)。进一步在改用三氟乙基酯重氮底物,并且在低温条件下进行反应的话,使得位置选择性与对映选择性提高到96:4,86%ee。
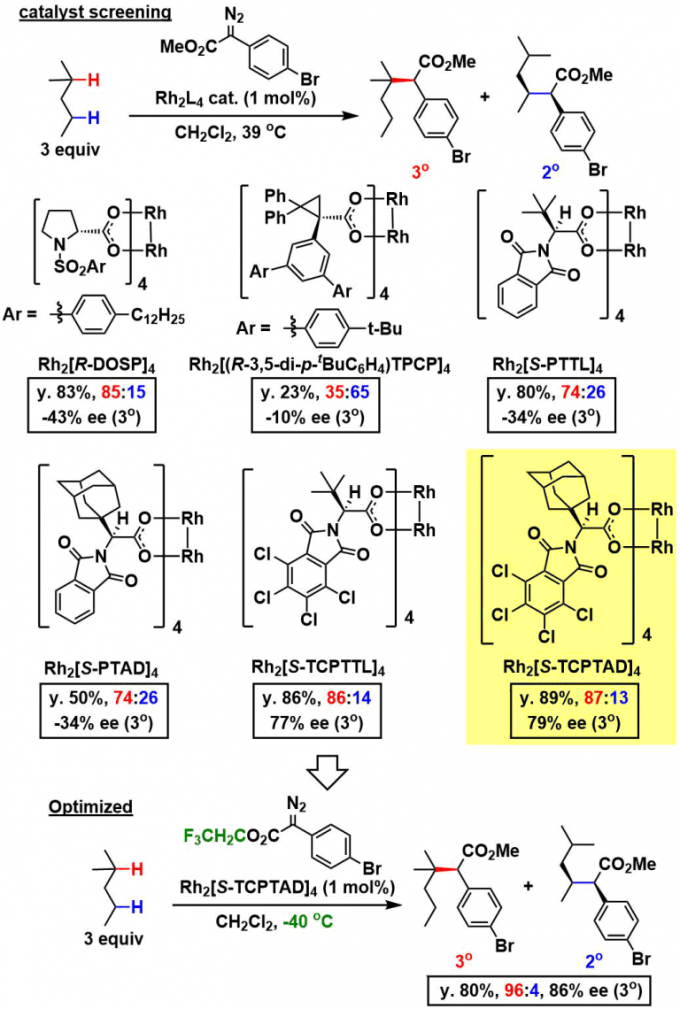
②底物的适用范围
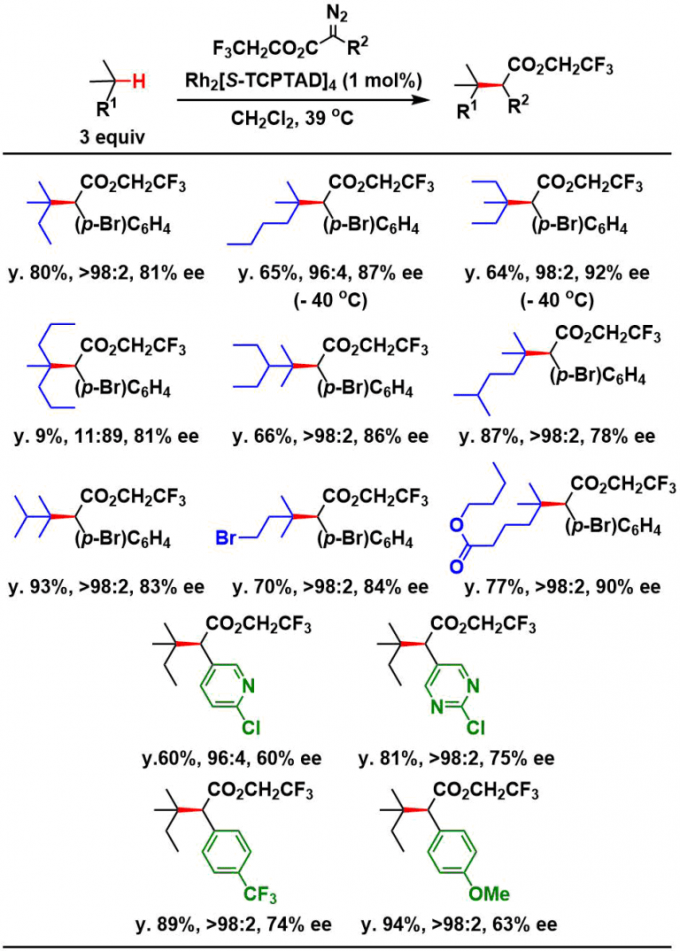
在没有官能团的链烷烃中,反应选择性的发生在3级C-H上,并且得到高产率,高对映选择性(77%-92%)的产物。但是,立体位阻很大3级C-H的底物的话,3级C-H上的选择性比较差,反应优先发生在立体位阻比较小的2级C-H上(2排最左边的底物)。
即使对于具有溴基和酯的底物,反应也以高产率进行,并且重氮酯侧的芳环位点也可以变化为含有杂环,三氟甲基,甲氧基的那些底物。
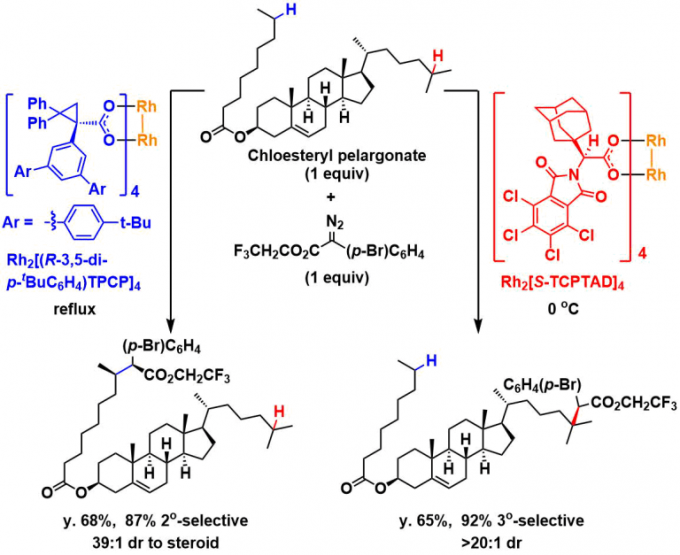
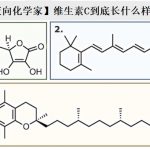
另外对于cholesteryl pelargonate、当使用报道的催化剂确认位置选择性的差异时、与期望相同Rh2[R-3,5-di(p–tBuC6H4)TPCP]4的话,反应优先发生在立体位阻小的2级C-H键上,而在使用Rh2[R-TCPTAD]4催化剂的时候,反应在3级C-H上选择性进行。
③选择性发现的原理
四氯邻苯二甲酰亚胺型配体通过其Cl-O键相互作用、据Charette等人报道,所有邻苯二甲酰亚胺都以面向一侧的形式固定(配体呈现All-up结构)[2],并且通过X射线单晶衍射证实了这一猜想。
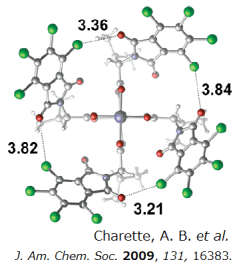
在邻苯二甲酰亚胺侧(a),有一个16.2Å宽的空间,而在面向金刚烷的一侧(b),只有7.8Å宽度的空间,这表明重氮酯(9.6Å)仅在邻苯二甲酰亚胺侧形成金属卡宾复合物。
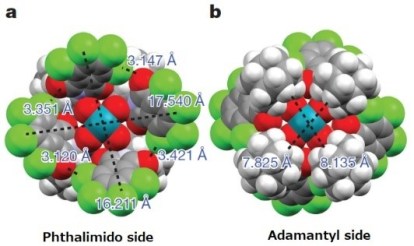
此外,作者通过计算发现,在卡宾形成后,一个Cl-O键断裂,并且邻苯二甲酰亚胺环和底物芳环发生π平面重叠以稳定卡宾中间体。 在π平面堆叠的状态下,反应优先发生与立体位阻小的Re面。
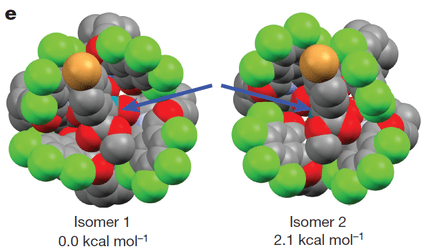
因此、Rh2[R-TCPTAD]4催化剂的情况下,由于形成的卡宾周围比较“空”,因此反应优先发生在比较富电子的3级碳氢上。
小编感言
- 这是一个不适用导向基团,单纯靠催化剂控制的选择性反应,可以说是一个比较划时代的反应方法学。然而,本论文中使用的底物中并没有出现烯丙基或者苄基,因此可以预见应该底物的依存性还是存在的。
- 另外最难的一级C-H的选择性反应还没有任何突破的迹象。
参考文献
- Liao, K.; Negretti, S.; Musaev, D. G.; Bacsa, J.; Davies, H. M. L. Nature 2016, 533, 230. doi:10.1038/nature17651
- (a) Lindsay, V. N. G.; Lin, W.; Charette, A. B. J. Am. Chem. Soc. 2009, 131, 16383. DOI: 10.1021/ja9044955 (b) Goto, T.; Takeda, K.; Shimada, N.; Nambu, H.; Anada, M.; Shiro, M.; Ando, K.; Hashimoto, S. Angew. Chem. Int. Ed. 2011, 50, 6803. doi:10.1002/anie.201101905
外部链接
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




















No comments yet.