2016年、伊利诺伊大学芝加哥分校・Vladimir Gevorgyan课题组、发现在Pd(0)催化剂存在下,可以通过可见光照射由芳基碘产生芳基钯自由基活性种。基于此推动的1,5-HAT过程作为起点、作者开发出了通过甲硅烷基醚脱氢反应的催化进程合成甲硅烷基烯醇醚的反应
“Photoinduced Formation of Hybrid Aryl Pd-Radical Species Capable of 1,5-HAT: Selective Catalytic Oxidation of Silyl Ethers into Silyl Enol Ethers”
Parasram, M.; Chuentragool, P.; Sarkar, D.; Gevorgyan, V.* J. Am. Chem. Soc.2016, 138, 6340. DOI: 10.1021/jacs.6b01628
课题设定
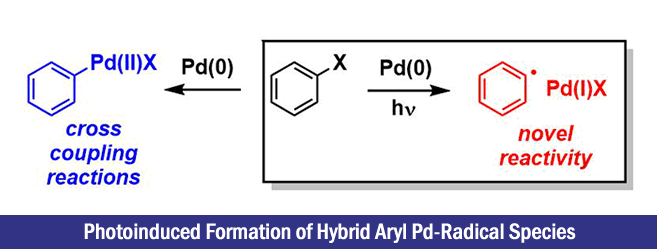
芳基卤化物是交叉偶联反应的重要原料,目前已使用钯催化剂体系合成了多种功能材料。在交叉偶联反应中,由氧化加成生成的Pd(II)参与反应。另一方面,如果可以产生芳基钯自由基,那么久可以探索利用钯化学和自由基化学两者相结合的新反应类型(参见标题图)。
解决方法
有一段时间,Gevorgyan及其同事正在积极研究使用甲硅烷基类导向基团的酚类底物的区域选择性C-H活化反应[1]。基于这项研究的技术基础,他们进行了一项假设,即芳基钯自由基进行的氢原子转移(HAT)过程可用于醇底物C(sp3)-H活化,并且基于这样的假设,进行了展开。具体而言,他们参考了Curran等人[2]报道的1,5-HAT型醇远程C – H官能化反应设计的反应体系。
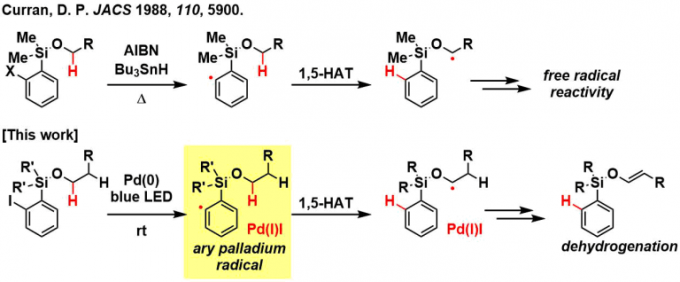
在该研究中,所得的碳自由基被芳基钯(I)捕获,然后通过β氢化物消除发生不饱和化,导致甲硅烷基烯醇醚的生成。
主张的有效性验证
①反应条件优化
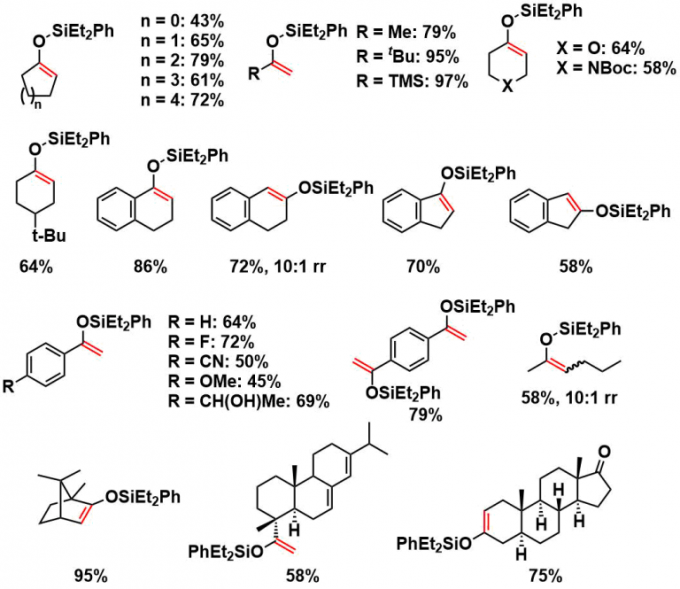
作者食用下图所示的底物,在常用的钯催化剂作用下进行了脱氢反应的讨论。在加热条件下完全不反应,然而当改用蓝光LED照射的条件时,反应顺利进行。并且在筛选配体发现,dppf类似物具有最好的反应活性。

②底物适用范围
不管是环状或者链状底物都适用于该反应。对于含有官能团的底物来说,产率在中~良好之间波动。链状产物的几何异构体在该条件下无法控制。本条件同样适用于拥有复杂骨架的底物。
③反应机理解析
对于下述的催化循环,Gevorgyan等人
- 氧化加成生成的4、没有通过当量反应确认到(由于立体位阻原因?)
- 通过氘代标记确认醚α位氢转移到了苯环
以此为根据、他们主张该反应不是通过CMD机理(Path B)、而是通过自由基机理(Path A)进行的。不饱和化的机理(A1-A3)的结论还没有阐明。
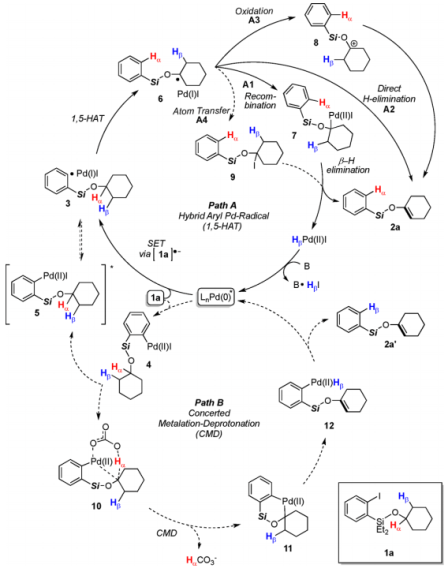
引用自原论文
小编所感
- 该研究是Gevorgyan在其多年的甲硅烷基类导向基团的研究上的一个展开与延伸。如果生成的碳自由基可以有效地进行transemetalization的话,那么应用范围会大大扩大。
- 而其实已经有报道表明蓝光LED可以加速偶联反应中氧化加成这一步[3]。
- 硅上的取代基如果是iPr的话,不利于该反应。而如果取代基是Me的话虽然反应也能进行,但是在纯化的时候貌似不稳定。
接下来需要读的相关论文?
- 不需要添加光敏催化剂,直接通过过渡金属催化剂(Co,Fe,Cu,Pd,Pt,Au)本身吸收可见光来促进反应发生[4]
- 作为该研究的后续Gevorgyan等人还实现了、脂肪族醇[5]・烯烃[6]的远端位的官能化。
参考文献
- Parasram, M.; Gevorgyan, V. Acc. Chem. Res. 2017, 50, 2038. DOI: 10.1021/acs.accounts.7b00306
- Curran, D. P.; Kim, D.; Liu, H. T.; Shen, W. J. Am. Chem. Soc. 1988, 110, 5900. DOI: 10.1021/ja00225a052
- (a) Wang, G.-Z.; Shang, R.; Cheng, W.-M.; Fu, Y. J. Am. Chem. Soc. 2017, 139, 18307. DOI: 10.1021/jacs.7b10009 (b) Wang, G.-Z.; Shang, R.; Fu, Y. Synthesis2018, 50, 2908. DOI: 10.1055/s-0036-1592000 (c) Wang, G.-Z.; Shang, E.; Fu, Y. Org. Lett. 2018, 20, 888. DOI: 10.1021/acs.orglett.8b00023 (d) Kurandina, D.; Rivas, M.; Radzhabov, M.; Gevorgyan, V. Org. Lett. 2018, 20, 357. DOI: 10.1021/acs.orglett.7b03591 (e) Abdiaj,I.; Huck, L.; Mateo, J. M.; de la Hoz, A.; Gomez , V.; Díaz‐Ortiz, A.; Alcázar, J. Angew. Chem. Int. Ed. 2018, 57, 13231. doi:10.1002/anie.201808654
- Parasram, M.; Gevorgyan, V. Chem. Soc. Rev. 2017, 46, 6227. doi:10.1039/C7CS00226B
- Parasram, M.; Chuentragool, P.; Wang, Y.; Shi, Y.; Gevorgyan, V. J. Am. Chem. Soc.2017, 139, 14857. DOI: 10.1021/jacs.7b08459
- Ratushnyy, M.; Parasram, M.; Wang, Y.; Gevorgyan, V. Angew. Chem. Int. Ed.2018, 57, 2712. doi:10.1002/anie.201712775
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!















No comments yet.