本文作者:杉杉
导读
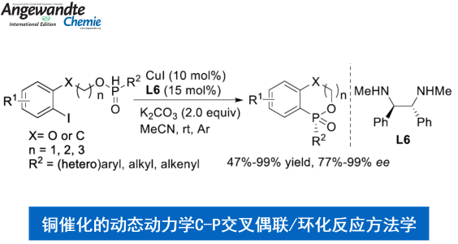
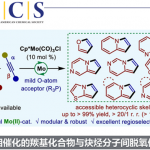
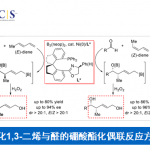
近日,临沂大学的杨文强课题组在Angew. Chem. Int. Ed.中发表论文,报道一种全新的通过铜催化剂促进的动态动力学芳基C-P交叉偶联/环化反应方法学,进而成功完成一系列具有P-立体生成中心 (P-stereogenic)的P-杂环分子的构建。
Copper-Catalyzed Dynamic Kinetic C–P Cross-Coupling/Cyclization for Concise Asymmetric Synthesis of Six-, Seven- and Eight-Membered P-Stereogenic Phosphorus Heterocycles
Y.Li, X.Jin, P. Liu, H. Zhang, X. Yu, Y. Liu, B. Liu, W. Yang, Chem. Int. Ed. 2022, ASAP. doi: 10.1002/anie.202117093.
正文
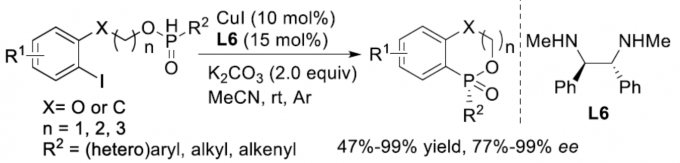
手性P-杂环化合物目前已经广泛应用于不对称催化领域的相关研究[1]。同时,对于手性P-杂环骨架构建的相关反应方法学研究,目前已经有诸多的文献报道 (Figure 1a) [2]-[3]。然而,对于具有P-立体生成中心 (P-stereogenic)的P-杂环分子构建 (Figure 1b),却较少有相关的研究报道[4]。这里,受到近年来对于催化对映选择性C-P交叉偶联/环化反应方法学相关研究报道[5]-[9]的启发,临沂大学的杨文强课题组报道一种全新的通过铜催化剂促进的H-次膦酸酯 (H-phosphinates)的动态动力学C-P交叉偶联/环化反应方法学,进而成功完成一系列具有P-立体生成中心(P-stereogenic) P-杂环分子的构建。
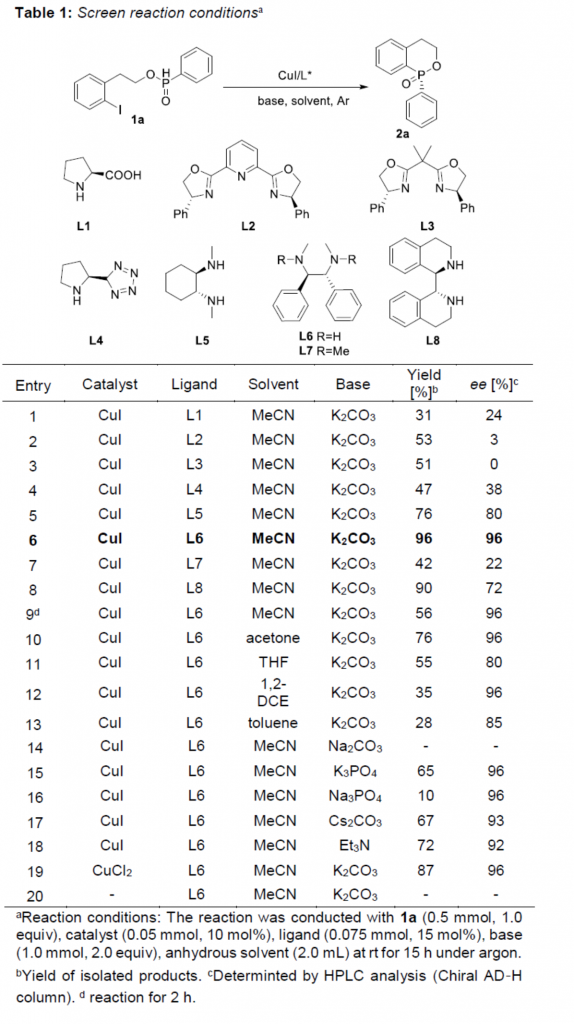
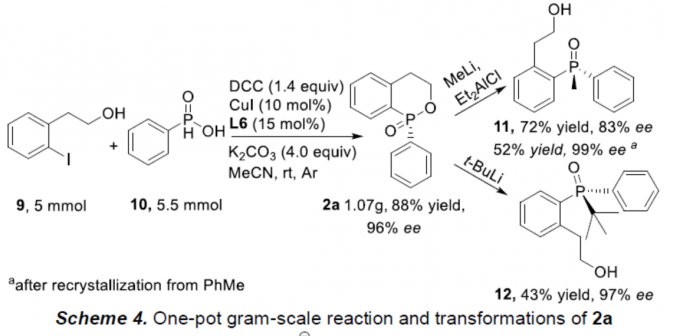
首先,作者采用1a作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用CuI作为催化剂,L6作为手性配体,K2CO3作为碱,MeCN作为反应溶剂,反应温度为室温,最终获得96% 收率的手性产物2a (96% ee)。
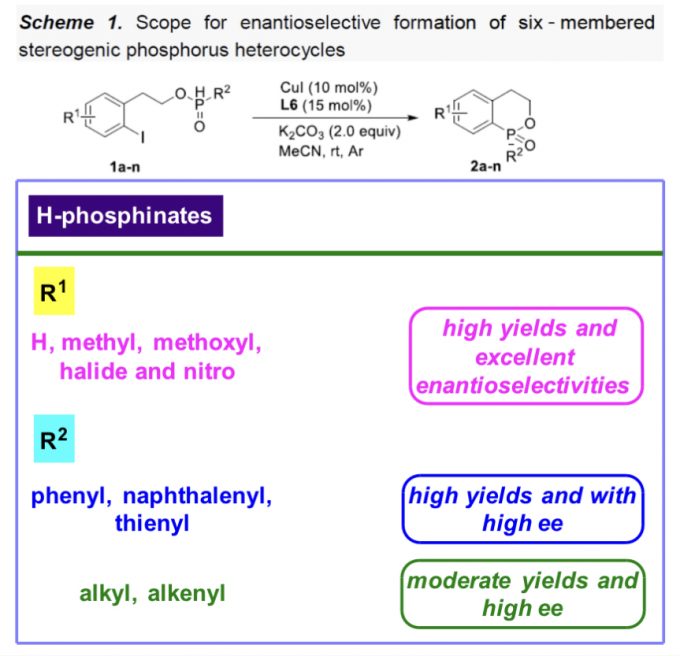
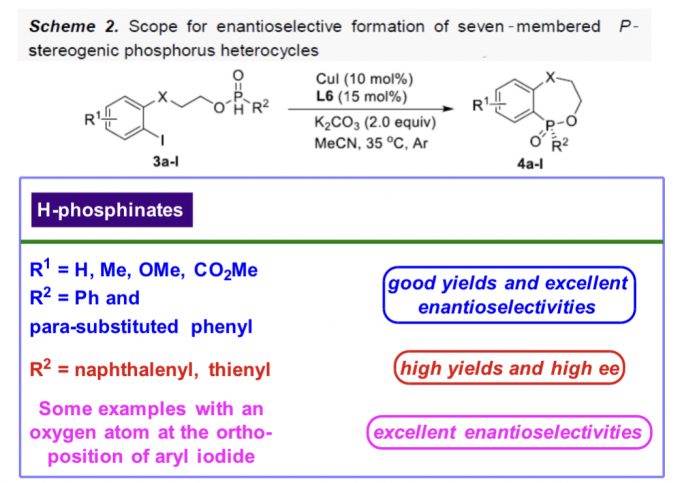
在上述的最佳反应条件下,作者对一系列H-次膦酸酯 (Scheme 1 and Scheme 2)底物的应用范围进行深入研究。
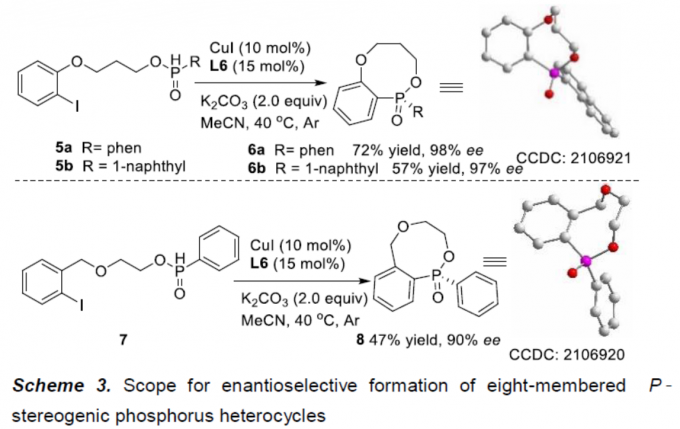
同时,该小组发现,将反应温度升高至40oC时,底物5a、5b与7均能够顺利地参与上述的动态动力学芳基C-P交叉偶联/环化反应过程,并以中等至良好的反应收率以及高度的对映选择性 (90-98% ee),获得相应的八元P-杂环手性分子6a、6b与8。
之后,该小组通过如下的一系列研究进一步表明,这一全新的对映选择性交叉偶联/环化策略具有潜在的合成应用价值 (Scheme 4)。
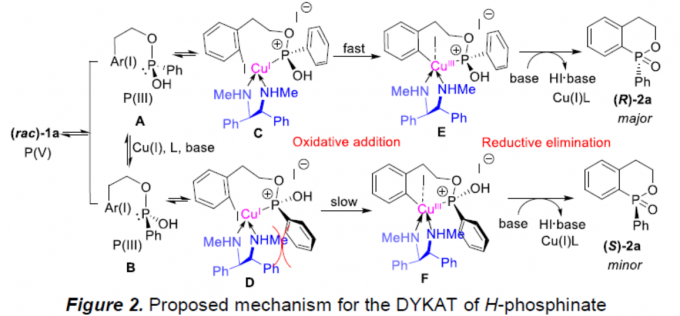
基于一系列相关的实验研究 (参阅SI)以及前期的文献报道[10]-[11],作者提出如下合理的反应机理 (Figure 2)。
总结
临沂大学的杨文强课题组报道一种全新的采用铜催化剂促进的对映选择性分子内C-P交叉偶联/环化反应方法学,进而成功完成一系列六、七、八元环P-立体生成中心含磷杂环分子的构建。这一全新的对映选择性合成转化策略具有温和的反应条件、良好的反应收率以及优良的对映选择性等优势。
参考文献
- [1] (a) G. Xu, C. H. Senanayake, W. Tang, Acc. Chem. Res. 2019, 52, 1101. doi: 10.1021/acs.accounts.9b00029.
- (b) S. L. Rossler, D. A. Petrone, E. M. Carreita, Acc. Chem. Res. 2019, 52, 2657. doi: 10.1021/acs.accounts.9b00209.
- [2] (a) J. Xie, Q. Zhou, Acc. Chem. Res. 2008, 41, 581. doi: 10.1021/ar700137z.
- (b) J. F. Teichert, B. L. Feringa, Angew. Chem. Int. Ed. 2010, 49, 2486. doi: 10.1002/anie.200904948.
- [3] (a) G. Hoge, J. Am. Chem. Soc. 2004, 126, 9920. doi: 10.1021/ja048079l.
- (b) L. Kolla´r, G. Keglevich, Chem. Rev. 2010, 110, 4257. doi: 10.1021/cr900364c.
- [4] X. Ye, L. Peng, X. Bao, C. Tan, H. Wang, Green. Synth. Catal. 2021, 2, 6. doi:
- 10.1016/j.gresc.2020.12.002.
- [5] (a) Y. Chen, W. Duan, J. Am. Chem. Soc. 2013, 135, 16754. doi: 10.1021/ja407373g.
- (b) O. Berger, J. L. Montchamp, J. Org. Chem. 2019, 84, 9239. doi: 10.1021/acs.joc.9b01239.
- [6] (a) K. M. H. Lim, T. Hayashi, J. Am. Chem. Soc. 2017, 139, 8122. doi: 10.1021/jacs.7b04570.
- (b) Y. Sun, N. Cramer, Chem. Sci. 2018, 9, 2981. doi: 10.1039/C7SC05411D.
- [7] (a) C. Wang, K. Huang, J. Ye, W. Duan, J. Am. Chem. Soc. 2021, 143, 5685. doi: 10.1021/jacs.1c02772.
- (b) S. Zhang, J. Xiao, Y. Li, C. Shi, L. Yi, J. Am. Chem. Soc. 2021, 143, 9912. doi: 10.1021/jacs.1c04112.
- (c) Q. Dai, L. Liu, J. Zhang. Angew. Chem. Int. Ed. 2021, 60, 27247. doi: 10.1002/anie.202111957.
- [8] (a) B. Wolfe, T. Livinghouse. J. Am. Chem. Soc. 1998, 120, 5116. doi: 10.1021/ja973685k.
- (b) E. Bergin, C. T. O′Connor, S. B. Robinson, E. M. McGarrigle, C. P. O′Mahony, D. G. Gilheany, J. Am. Chem. Soc. 2007, 129, 9566. doi: 10.1021/ja072925l.
- [9] T. J. Brunker, B. J. Anderson, N. F. Blank, D. S. Glueck, A. L. Rheingold, Org. Lett. 2007, 9, 1109. doi: 10.1021/ol0700512.
- [10] T. Liu, J. Feng, C. Chen, Z. Deng, R. Kotagiri, G. Zhou, X. Zhang, Q. Cai, Org. Lett. 2019, 21, 4505. doi: 10.1021/acs.orglett.9b01373.
- [11] (a) J. L. Montchamp, Acc. Chem. Res. 2014, 47, 77. doi: 10.1021/ar400071v.
- (b) D. Gatineau, D. H. Nguyen, D. Hérault, N. Vanthuyne, J. Leclaire, L. Giordano, G. Buono, J. Org. Chem. 2015, 80, 4132. doi: 10.1021/acs.joc.5b00548.



















No comments yet.