经典的天然物化学在创药历史中做出了必不可少的贡献。
但是,从天然资源(植物、动物、微生物等)中采取样品发现其生物活性,再将活性物质制成药物,这种抄捷径式的创药模式,如今有种逐渐到达极限的感觉。
化学家们在全世界范围内搜寻着有创药可能性的化学物,结果发现:身边找到的活性天然物结构总好似哪里见过,是已知物质的情况不断增加。除非是去丛林或者深海之类的地方寻找,否则可以说找到新化学物质的现状实为艰辛。此外另一个原因是近年来成为主流的高通量筛选技术(HTS)亲和性较低。
不过,就像之后会谈到的,天然物式医药骨架被认为拥有巨大魅力。在这样的背景下,我们讨论一下不仅仅依赖天然,而是将人工合成反应联系起来创造先导药物方法的可行性。
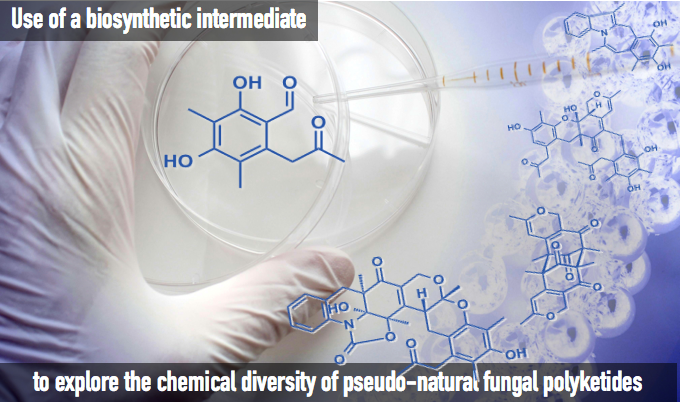
此次我们将日本东北大学药学部的浅井 大岛等人于前不久在Nature Chemistry上发表的研究[1]介绍给大家,同时也将对作者进行的采访整理一起送给大家。
“Use of a biosynthetic intermediate to explorethe chemical diversity of pseudo-natural fungal polyketides” Asai, T.; Tsukada, K.; Ise, S.; Shirata, N.; Hashimoto, M.: Fujii, I.; Gomi, K.; Nakagawara, K.; Kodama, E. N.; Oshima, Y. Nat. Chem. 2015, DOI: 10.1038/NCHEM.2308
作为医药候选化合物的天然物:魅力和问题
现代,尽管人们对于新药候选化合物的探索仍在倾注不断的努力,但以难治愈性疾病为主要目标的现代医疗中,发现有效的先导药物的门槛不断抬高。在这样的漩涡中,基础研究在新药创药率上做出的贡献具有着巨大价值。
上述所示,虽然探索效率上困难,但是天然物药物从未从新药开发的阵营中被舍弃过。
天然物因为具有特殊的结构特性(缩环、sp3结构丰富、高度氧化等)从创药观点来看是颇具魅力的。这些特性也是与医药品有效特性(生物体适合性、目标特异性、水溶性等)紧密相关的[2]。
从天然物中起源的医药品占每年新承认医药品的20~50%,这一数据不正是说明了这一点吗?
但是,直接从天然物中提取的物质不能用于医药品的例子很多。那些化合物并没不是总带有着完美的医药特性。
所以就有了这样的想法:将提取到的天然物进行人工加工制成功能上更有优势的化合物。也可称为半合成(semi-synthesis)或者衍生化(derivatization)方法。
尽管如此,目前的研究还是以在化合物表面做些装饰的例子占大多数。从骨架角度入手还很困难,能做出这样的人工化学反应的例子,在全世界几乎没有。
有人说:既然如此,那就从骨架开始人工合成的话不就好了?
话虽如此,但这也不是简单的事呀。假若将能合成出的1mg物质的天然物全合成研究继续应用于实践,想想就知道不是容易的事。花费数十个工程,九牛二虎之力合成出了复杂的骨架,再一一做生物活性评价……这要是用在新药开发上,无论是探索效率还是成本都是不现实的。
简而言之,虽然我们想要更多的拥有天然物类似的复杂骨架的化合物(这样就更容易新药研发),但问题是能简单地提供出这样的技术和方法还是少之又少。
「多样性指向型半合成」
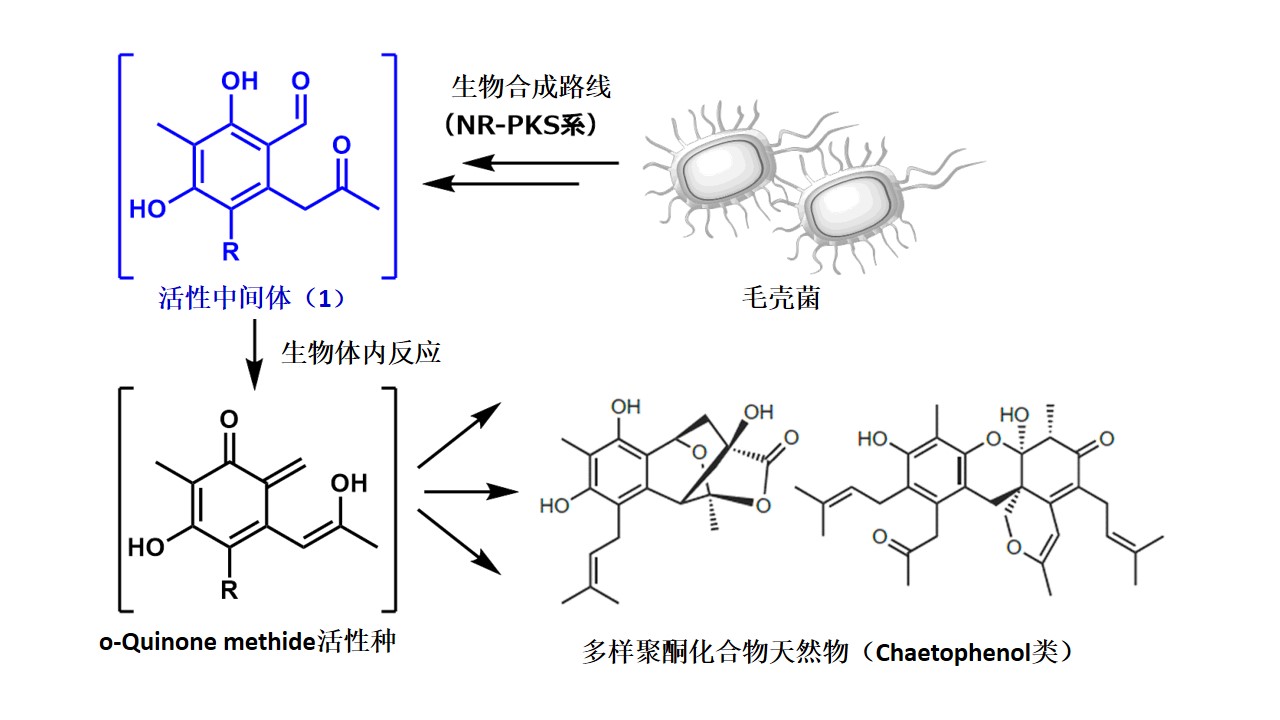
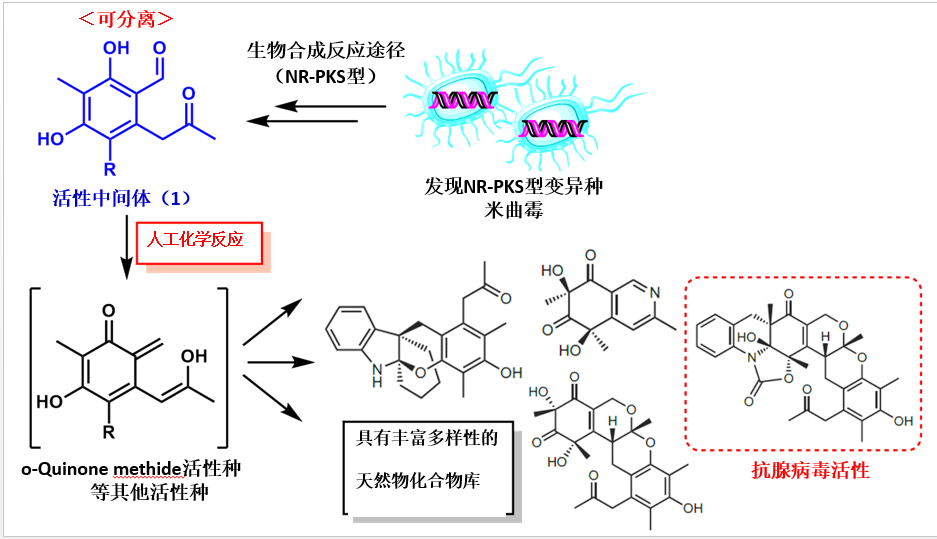
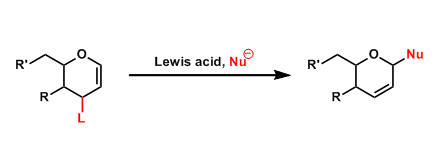
此次发表的文章,可以说就是解决上述问题的方法之一。基本想法其实非常简单,即选取作为天然物前驱体的「反应性中间体」进行人工变换。所谓的前驱体就是天然物的接合点,即便如此也是十分重要的复杂性结构。不仅在人工变换上有考究,其复杂的天然物式骨架也很容易使其诱导,甚至可能得到自然界得不到的骨架。
此外,也预示着在还未探索到的地方还有可成为医药骨架的可能。
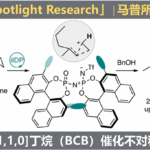
为了证实预想,本论文作者等人从毛壳菌产生的聚酮化合物(polyketide)天然物前驱体[4]、可能产生o-Quinone methide活性种化合物1入手,拥有着反应性更高、通过极为简单的反应便可诱导新骨架的巨大潜能。
但是,说到底是前驱体,就那么培养的话菌体内就被消耗了,这样的话化合物1根本得不到足够人工变换所需量。
于是研究者下了一番功夫,在此生合成中发现可将必要酶(NR-PKS)变种为米曲霉,期待的活性中间体1的大量制造就有他法可取。
这样得到的化合物1就可以用于各种人工反应中,诱导得到多种多样的骨架。在这个过程中,收率必然不会太高的40种新规化合物分离解,解析其构造。这些地方虽并没有一一列出,但是也可以推测出付出的那些辛苦。从这点上就可以感受到作为天然物化学研究者的骄傲感。
运用此方法制得的新规化合物具有抗腺病毒活性(EC50 = 4.6 μM)。目前还并没有对腺病毒有效的药物,此次发现可以说对于医药探索上来讲是具有实效性成果的。
此方法的优点是:当想要寻找天然的医药候补品时没有必要每次都要去丛林深海之处采集样品。
虽然是半开玩笑的话,不过通过基因转换菌内生产反应性中间体、因为是加以需要的人工反应得到的骨架,如果作为具有能大量合成生物活性的类天然物化合物的方法来看,也是具有实效性的简单方法吧。可以说和现在的合成生物学并肩起跑,未来也会更上一层楼。在实际应用中也能发挥其作用。
生产出骨架水平的多样性构造,虽然这种想法(多样性指向型合成)从被提案至今已经时隔许久,但是本论文作者们 通过组合发现异种的形式继续在这条路上前行着,他们将此方法命名为「多样性指向型半合成(Diversity-oriented semi-synthesis)」
此外,从创药化学的角度眺望,此方法是全合成和天然物化学以及合成生物学的中间位置的一种方法和获取手段。或许,也只是一种不太可能的方法?没准也可以这么说。
在天然物创药领域中,让我感到还有很多很多可以做的事情。最后附上本论文作者等人对于本研究感言,敬请浏览。
作者感言
我们在运用化学遗传学方法对天然物探索研究中发现,通过添加HDAC阻碍剂培养Chaetomium indicum可以得到具有多样构造的新规芳香族聚酮chaetophenol类化合物。
这过程中常会被问到:「次级代谢活性化表观遗传学会因为HDAC的阻碍剂而受到控制吗?」
为了试着验证一下,我们将与chaetophenol类化合物的产生相关的非还原型聚酮合成酶(NR-PKS)密码子和基因pksCH-2作了标示。
这在我们之前的生合成工作实验中从未出现过,所以pksCH-2作为曲霉异种发现时理应作为最初基因留念。当初我们原以为能从过剩的pksCH-2株中得到最单一构造的苯甲醛诱导体。但是,用一直以来使用的PDB培养基得到的结构,却相反得到了聚酮化合物二量体。
从这个偶然的发现中,我们明白了此研究的关键是在于通过曲霉内在酶将苯甲醛还原为苯并吡喃的环化反应。发现了这种所谓非酶式的二量体的一系列变换。此外,也明白了二量体的生成比与Ph的相互关系。最初选择曲霉培养基时,使用了常用的CDS培养基,所以并没有注意到这一点。之后,通过利用生合成中间体的Isochromene潜在的高反应性,向着多样性类天然产物的创造生成上展开研究。
在这过程中,即便是有机反应非专业研究者也知道,副反应处处存在。虽然合理的反应并不中意,但是我们依旧坚守本分「筛选」,从复杂的反应混合物中提取微量生成物,再决定其构造。利用这样的优势,即便是产量只有百分之几的物质也不顾一切奋力前行的结果,就是得到了更多样的非天然性聚酮分子物质。
我们坚信偶然的发现与超越自我换来的成果息息相关,运用生物合成化学与有机反应相结合,再加上「筛选」的手法才得以将这项研究顺利完成。
如今回过头看去,绝不能说最初是瞄准了目标开始的研究。但是,在不同的领域中穿梭,因为知识不足 对结果一一真诚面对,才得打开新的道路。我们也真诚感谢能在这条研究道路上同时学到了更多的知识。
想告诉正在阅读本文的学生们,有时候出现的那些没有考虑过的结果,或许是一个机遇。珍惜这样的巧合,才能体会到研究的乐趣。
此外,本研究的共同研究者均所属于东北地区团队,能由东北带动起全日本的天然物化学的活跃气氛的我们倍感荣幸。
日本东北大学 浅井禎吾、大島吉輝
引用文献
- 1. “Use of a biosynthetic intermediate to explorethe chemical diversity of pseudo-natural fungal polyketides” Asai, T.; Tsukada, K.; Ise, S.; Shirata, N.; Hashimoto, M.: Fujii, I.; Gomi, K.; Nakagawara, K.; Kodama, E. N.; Oshima, Y. Nat. Chem. 2015, DOI: 10.1038/NCHEM.2308
- 2. “The evolving role of natural products in drug discovery”, Koehn, F. E.; Carter, G. T. Nat. Rev. Drug. Discov. 2005, 4, 206. doi:10.1038/nrd1657
- 3. “Natural Products As Sources of New Drugs over the 30 Years from 1981 to 2010” Newman, D. J.; Cragg, G. M. J. Nat. Prod. 2012, 75, 311. DOI: 10.1021/np200906s
- 4. “Structurally Diverse Chaetophenol Productions Induced by Chemically Mediated Epigenetic Manipulation of Fungal Gene Expression” Asai, T.; Yamamoto, T.; Shirata, N.; Taniguchi, T.; Monde, K.; Fujii, I.; Gomi.K.; Oshima, Y. Org. Lett. 2013, 15, 3346. DOI: 10.1021/ol401386w
相关链接
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!