作者 炸鸡
在《走进消除反应Elimination Reactions(2)——是E1还是E2?》中,笔者为读者介绍了不同消除机理以及不同消除机理的特点和之间的差别。今天这期笔者将介绍消除反应E1机理下诞生的不同产物。
请读者看下面这个化合物(图1),如果这个化合物发生E1消除反应,读者不妨尝试写写产物。
图1
发现了没有?如果这个化合物发生消除反应,它的可能产物其实有很多!(图2)但这并不是说实际反应结束后我们会收获不同产物的混合体,消除反应会特定或有偏向性地生成哪些产物是有迹可循的。下面让我们来看看吧!
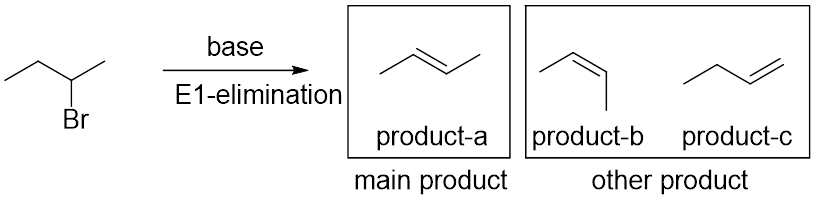
图2
E1消除反应机理
在前回我们说到E1反应包括离去基团的离去,碳正离子的形成,碳氢键的断裂,双键的形成等四个步骤(图3)。
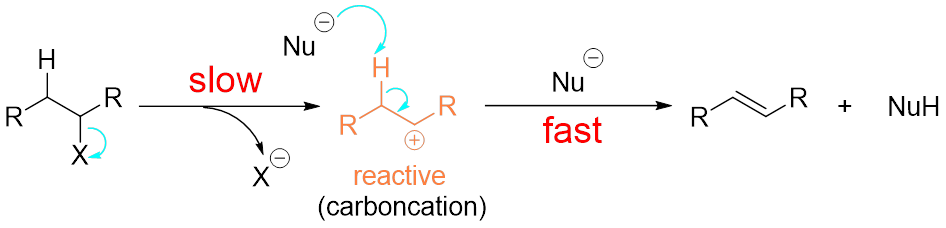
图3
可以看出,生成什么样的产物取决于碳正离子的哪个β-碳上的氢被夺取(图4)。
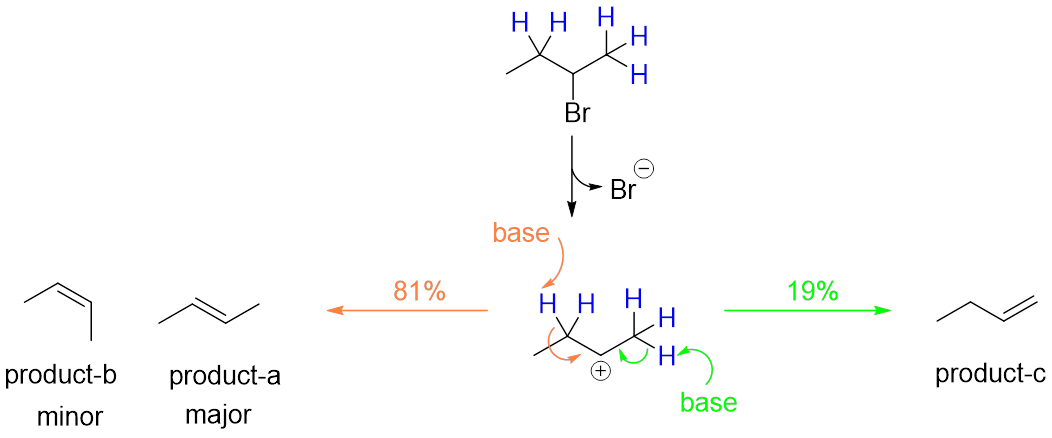
图4
如图所示,潜在的可以被夺取的氢有2个,分别对应生成a,b和c。但实际中主产物只有a,,这说明E1反应实际在“有偏向性地”失去β-氢。同时有多个β–氢时,E1反应会选择失去那个能够生成更稳定产物的氢。多个β-氢可以来自同一个碳,也可以来自不同的碳。在同碳β-氢之间做选择造成了E1反应的立体选择性(产物化学式一样,但立体构造不一样,比如product a 和product b),在异碳β-氢之间做选择造成了E1反应的区域选择性(regioselectivity)(产物的化学式和立体结构都不同,比如product c和product b)。
E1反应的立体选择性-同碳β-氢之间的选择
当有两个潜在的可以被夺取的β-氢时,更稳定的E型异构体会成为主产物,较不稳定的Z型异构体会成为副产物(图5)。为什么会倾向于生成更稳定的产物呢?
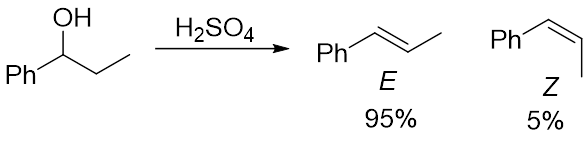
图5
形成碳正离子后,β-碳是可以自由旋转的(饱和碳嘛,可以自由旋转咯),但只有当β–碳上的C-H键与碳正离子的空的p轨道平行才可以形成新的双键。(图6)
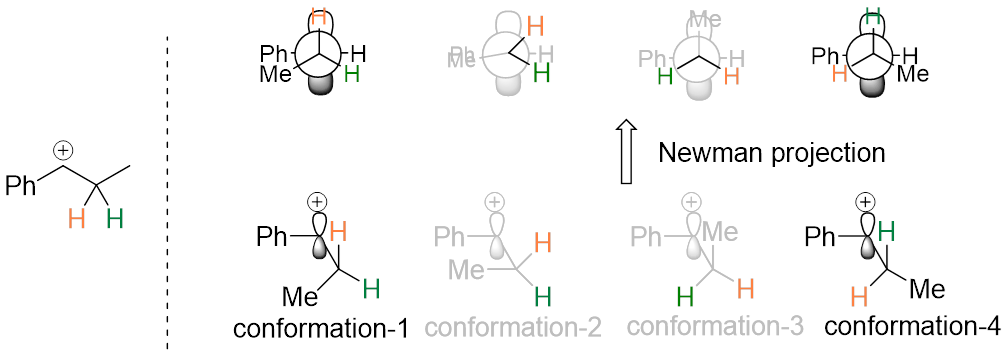
图6
所以有两个构象符合要求,分别是构象1和构象4。但因构象4的空间位阻小,具有更低的能量,所以构象4会快速生成。这种能量的高低对比也同样呈现在形成的过渡态及后生成的产物上:不稳定的构象1生成能量高的过渡态,然后生成不稳定的Z构型,稳定的构象4生成能量低的过渡态,然后生成稳定的E构型。(图7)
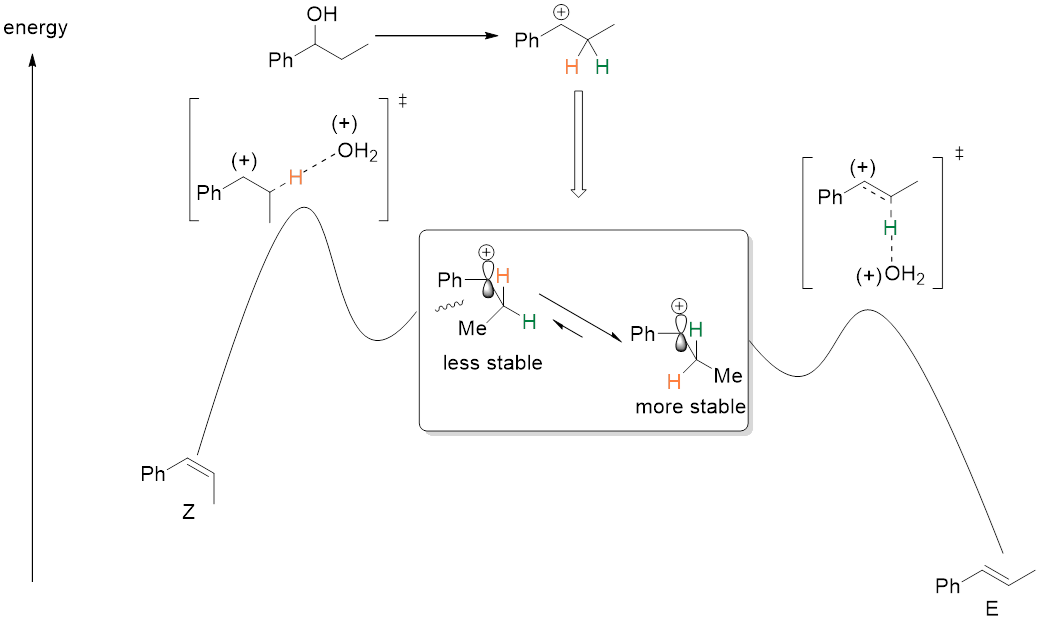
图7(改编自[1])
需要注意的是,决定一个取代烯烃是E构型还是Z构型靠的是取代基的编号,大部分情况下E构型比Z构型稳定,但有时候却不是(图8),这时候,Z构型反而是更稳定的那个,如果是消除反应产物,是作为主产物生成的。
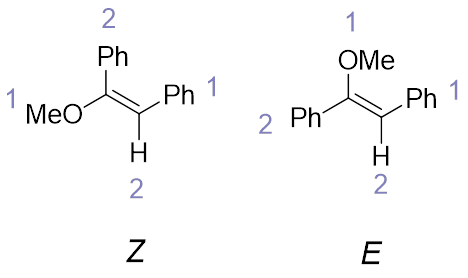
图8
E1反应的立体选择性-异碳β-氢之间的选择
当有不止一个的β-碳时,双键上连有更多取代基的产物更稳定,会成为主产物,双键上取代基较少的产物较不稳定,会成为副产物。(图9)
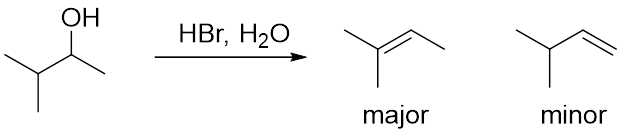
图9
在解释这个现象的原因之前,我们先来复习一个知识点:什么样的双键才算是稳定的双键?
双键由一个σ键加一个π键组成,π键由两个各有一个电子的p轨道构成。π键相较于σ键比较不稳定,让π键稳定的方法就是向它的反键轨道(π*)“输送”电子。这和我们上期讲的稳定的碳正离子很类似。当双键上的取代基有能与π*键平行的σ键时,σ键上的电子会帮助稳定π*键,双键也就更稳定,或是有能与双键共轭的官能团(羰基,芳基,硝基等)(图10)
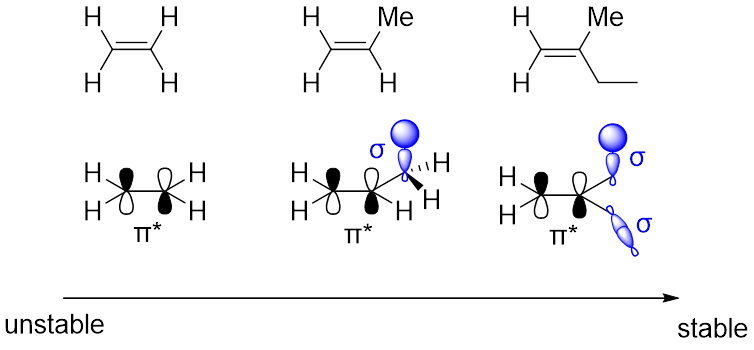
图10
在过渡态中,有较多烷基取代基的过渡态具有更低的能量,所以生成速率很快,主产物自然就是有较多烷基取代基的烯烃。
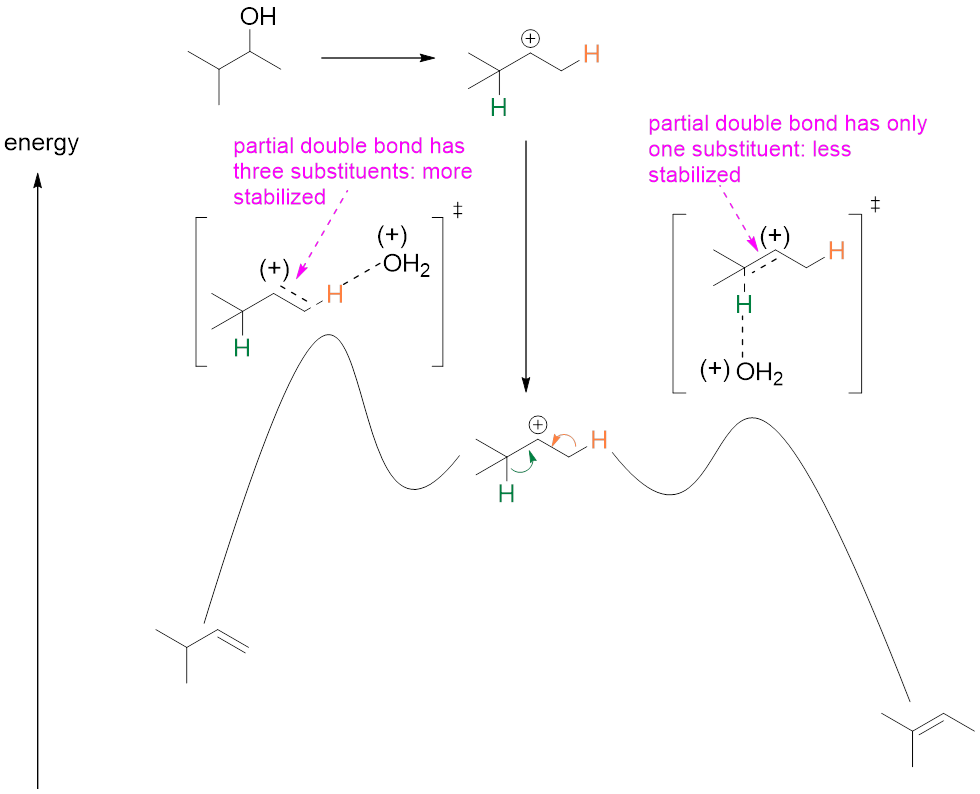
图11(节选自[1])
参考文献
[1] J. Clayden, N. Greeves, S. Warren, 2012. Organic Chemistry. Great Clarendon Street, Oxford: Oxford University Press. 1187pp. 2nd edition. [2] F. A. Carey, R.J. Sundberg, Advanced Organic Chemistry Part A: Structure and Mechanisms.封面图片来自:Image by <a href=”https://www.freepik.com/free-vector/science-lab-with-objects_7405691.htm#query=chemical%20reaction&position=7&from_view=keyword&track=ais&uuid=c9ebc29e-3e39-4c5d-8000-993a1cf63f69″>Freepik</a>
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.


















No comments yet.