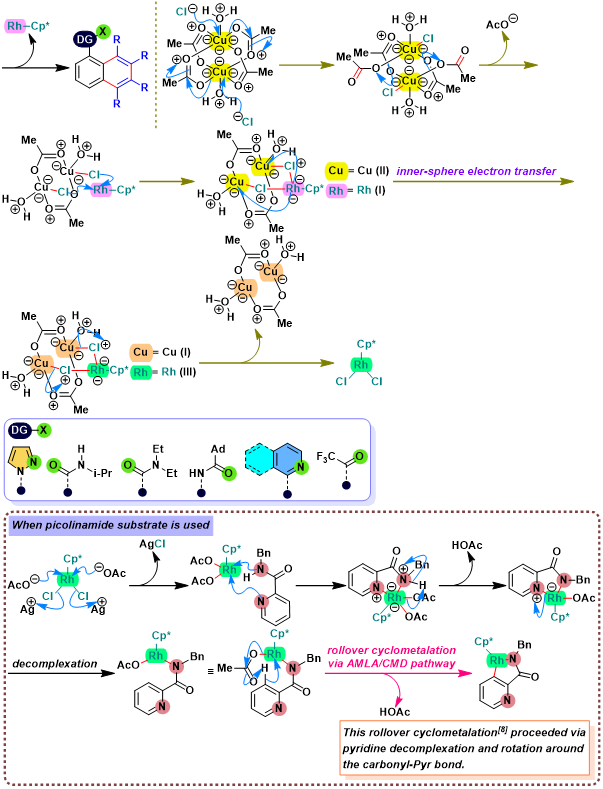
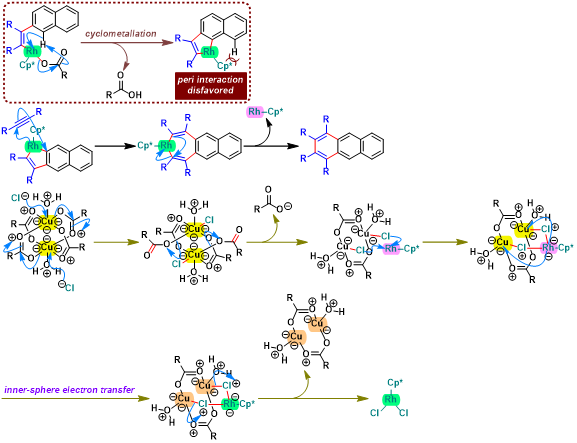
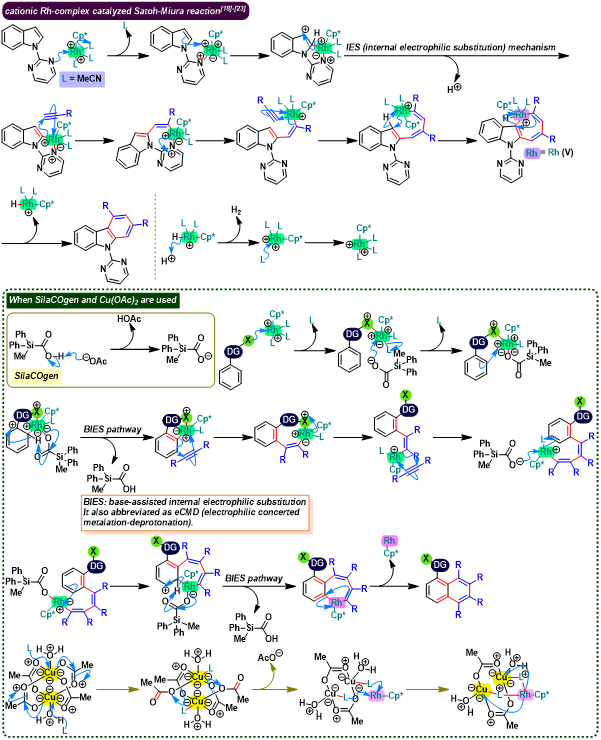
概要
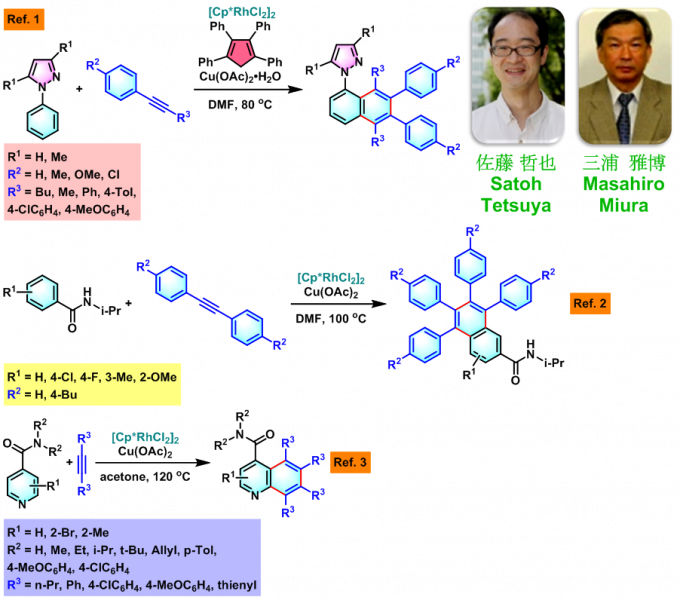
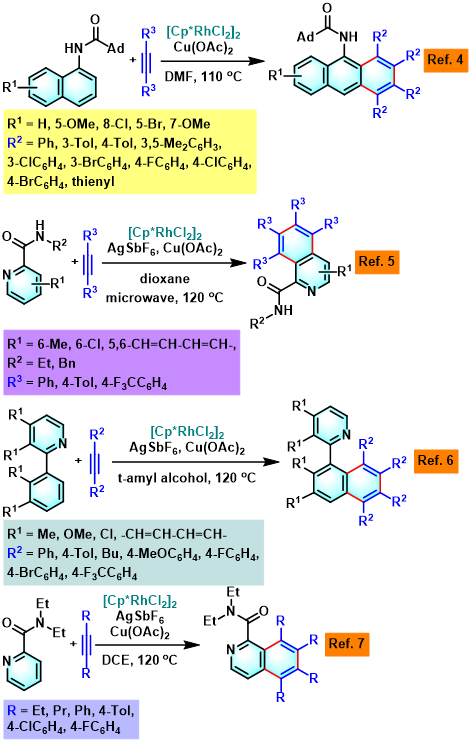
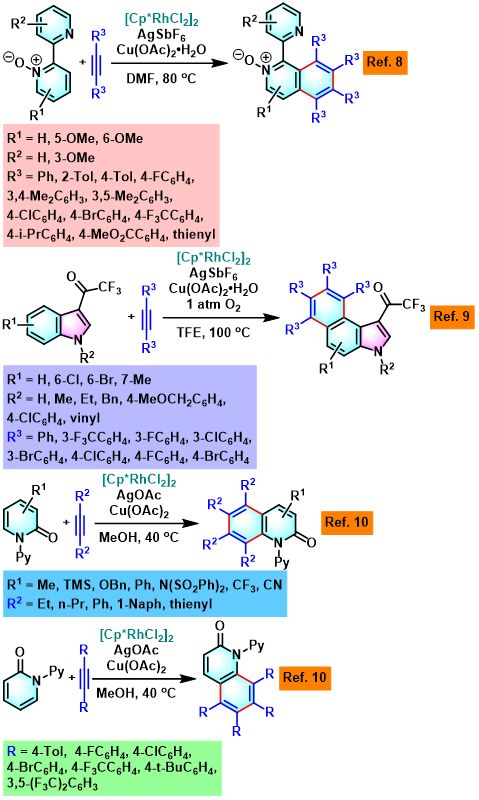
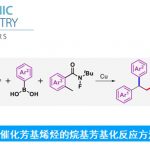
Satoh-Miura 反应 (Satoh-Miura reaction) 是各类芳香化合物或杂环芳香化合物在过渡金属催化剂 (主要涉及Rh催化剂[1]-[15]、Pd催化剂[16]-[19]、Co催化剂[20]、Ni催化剂[21]-[22]、Mn催化剂[23])存在下,通过双重C-H键活化过程,进行的区域选择性芳香同系化反应 (aromatic homologation reaction, 又称为去氢环化反应,dehydrogenative annulation或芳烃-炔苯环化,arene-alkyne benzannulation)。该反应由日本Osaka 大学工学部应用化学系 (大阪大学工学部応用化学科, Department of Applied Chemistry, Faculty of Engineering, Osaka University)的Satoh (佐藤 哲也, Satoh Tetsuya)与Miura (三浦 雅博, Masahiro Miura)研究室在2008年首次报道[1]。
Satoh-Miura 反应具有广泛的底物适用范围,中等至良好的反应收率与优良的原子经济性以及优良的区域选择性。这一反应的发展为芳烃同系化方法学的研究开辟了全新的途径[1]-[24]。目前,该反应已经广泛应用于一系列稠环芳烃与稠合芳香杂环分子[25]以及部分功能性高分子的构建[26]。因篇幅限制,这里小编只介绍Rh催化剂参与的Satoh-Miura 反应。对于其它过渡金属催化剂参与的Satoh-Miura 反应,小编将在下一期进行介绍。
基本文献
[1] N. Umeda, H. Tsurugi, T. Satoh, M. Miura, Angew. Chem. Int. Ed. 2008, 47, 4019. doi: 10.1002/anie.200800924. [2] Z. Shi, C. Tang, N. Jiao, Adv. Synth. Catal. 2012, 354, 2695. doi: 10.1002/adsc.201200372. [3] G. Song, X. Gong, X. Li, J. Org. Chem. 2011, 76, 7583. doi: 10.1021/jo201266u. [4] X. Zhang, X. Yu, D. Ji, Y. Yamamoto, A. I. Almansour, N. Arumugam, R. S. Kumar, M. Bao, Org. Lett. 2016, 18, 4246. doi: 10.1021/acs.orglett.6b01991. [5] A. M. Martinez, J. Echavarren, I. Alonso, N. Rodriguez, R. G. Arrayas, J. C. Carretero, Chem. Sci. 2015, 6, 5802. doi: 10.1039/C5SC01885D. [6] J. Zheng, S. You, Chem. Commun. 2014, 50, 8204. doi: 10.1039/C4CC02822H. [7] B. Shi, Z. Qian, J. Zhou, B. Li, Synlett 2014, 25, 1036. doi: 10.1055/s-0033-1340870. [8] X. Xu, H. Zhao, J. Xu, C. Chen, Y. Pan, Z. Luo, Z. Zhang, H. Li, L. Xu, Org. Lett. 2018, 20, 3843. doi: 10.1021/acs.orglett.8b01434. [9] K. R. Bettadapur, R. Kapanaiah, V. Lanke, K. R. Prabhu, J. Org. Chem. 2018, 83, 1810. doi: 10.1021/acs.joc.7b02719. [10] A. Biswas, D. Giri, D. Das, A. De, S. K. Patra, R. Samanta, J. Org. Chem. 2017, 82, 10989. doi: 10.1021/acs.joc.7b01932. [11] H. Li, X. Yan, J. Zhang, W. Guo, J. Jiang, J. Wang, Angew. Chem. Int. Ed. 2019, 58, 6732. doi: 10.1002/anie.201901619. [12] M. V. Pham, N. Cramer, Angew. Chem. Int. Ed. 2014, 53, 3484. doi: 10.1002/anie.201310723. [13] J. Jia, J. Shi, J. Zhou, X. Liu, Y. Song, H. E. Xu, W. Yi, Chem. Commun. 2015, 51, 2925. doi: 10.1039/C4CC09823D. [14] S. Li, C. Wang, W. Li, X. Zhang, L. Dong, Tetrahedron 2016, 72, 2581. doi: 10.1016/j.tet.2016.03.092. [15] S. Li, C. Wang, H. Lin, X. Zhang, L. Dong, Org. Lett. 2015, 17, 3018. doi: 10.1021/acs.orglett.5b01228. [16] K. Fukuzumi, Y. Unoh, Y. Nishii, T. Satoh, K. Hirano, M. Miura, J. Org. Chem. 2016, 81, 2474. doi: 10.1021/acs.joc.6b00030. [17] O. S. Kim, J. H. Jang, H. T. Kim, S. J. Han, G. C. Tsui, J. M. Joo, Org. Lett. 2017, 19, 1450. doi: 10.1021/acs.orglett.7b00410. [18] P. Annamalai, W. Chen, S. Raju, K. Hsu, N. S. Upadhyay, C. Cheng, S. Chuang, Adv. Synth. Catal. 2016, 358, 3642. doi: 10.1002/adsc.201600488. [19] J. Wu, X. Cui, X. Mi, Y. Li, Y. Wu, Chem. Commun. 2010, 46, 6771. doi: 10.1039/C0CC01448F. [20] Y. T. Wu, K. H. Huang, C. C. Shin, T. C. Wu, Chem.–Eur. J. 2008, 14, 6697. doi: 10.1002/chem.200800538. [21] Q. Li, Y. Wang, B. Li, B. Wang, Org. Lett. 2018, 20, 7884. doi: 10.1021/acs.orglett.8b03438. [22] L. C. M. Castro, A. Obata, Y. Aihara, N. Chatani, Chem.–Eur. J. 2016, 22, 1362. doi: 10.1002/chem.201504596. [23] Z. He, Y. Huang, ACS Catal. 2016, 6, 7814. doi: 10.1021/acscatal.6b02477. [24] L. Shi, X. Zhong, H. She, Z. Lei, F. Li, Chem. Commun. 2015, 51, 7136. doi: 10.1039/C5CC00249D. [25] S. Li, L. Qin, L. Dong, Org. Biomol. Chem. 2016, 14, 4554. doi: 10.1039/C6OB00209A. [26] M. Gao, J. W. Y. Lam, Y. Liu, J. Lia, B. Z. Tang, Polym. Chem. 2013, 4, 2841. doi: 10.1039/C3PY00045A.反应机理
参考文献
[1] R. A. Alharis, C. L. McMullin, D. L. Davies, K. Singh, S. A. Macgregor, Faraday Discuss. 2019, 220, 386. doi: 10.1039/C9FD00063A. [2] A. J. Nielson, J. Harrison, M. A. Sajjad, P. Schwerdtfeger, Eur. J. Inorg. Chem. 2017, 2255. doi: 10.1002/ejic.201700086. [3] M. A. Sajjad, K. E. Christensen, N. H. Rees, P. Schwerdtfeger, J. A. Harrison, A. J. Nielson, Chem. Commun. 2017, 53, 4187. doi: 10.1039/C7CC01167A. [4] L. Ackermann, Chem. Rev. 2011, 111, 1315. doi: 10.1021/cr100412j. [5] I. Funes-Ardoiz, F. Maseras, Angew. Chem. Int. Ed. 2016, 55, 2764. doi: 10.1002/anie.201510540. [6] I. Funes-Ardoiz, F. Maseras, ACS Catal. 2018, 8, 1161. doi:10.1021/acscatal.7b02974. [7] J. Jiang, R. Ramozzi, J. Morokuma, Chem.–Eur. J. 2015, 21, 11158. doi: 10.1002/chem.201501539. [8] B. Butschke, H. Schwarz, Chem. Sci. 2012, 3, 308. doi: 10.1039/C1SC00651G. [9] K.Sreenath, Z. Yuan, M. M.-C. V. Ramachandran, R. J. Clark, L. Zhu, Eur. J. Inorg. Chem. 2016, 3728. doi: 10.1002/ejic.201600540. [10] H. Sigel, C. Flierl, R. Griesser, J. Am. Chem. Soc. 1969, 91, 1061. doi: 10.1021/ja01033a004. [11] N. Cramer, J. Mas-Roselló, A. G. Herraiz, B. Audic, A. Laverny, Angew. Chem. Int. Ed. 2020, 59, Early View. doi: 10.1002/ange.202008166. [12] L. Han, X. Ma, Y. Liu, Z. Yu, T. Liu, Org. Chem. Front. 2018, 5, 725. doi: 10.1039/C7QO00911A. [13] M. V. Pham, N. Cramer, Chem.– Eur. J. 2016, 22, 2270. doi: 10.1002/chem.201504998. [14] Y. W. Suh, G. R. Buettner, S. Venkataraman,S. E. Treimer, L. W. Robertson , G. Ludewig, Environ. Sci. Technol. 2009, 43, 2581. doi: 10.1021/es8022978. [15] J. Wencel-Delord, C. Nimphius, H. Wang, F. Glorius, Angew. Chem. Int. Ed. 2012, 51, 13001. doi: 10.1002/anie.201205734. [16] S. R Chemler, S. Karyakarte, Z. M. Khoder, J. Org. Chem. 2017, 82, 21, 11311. doi: 10.1021/acs.joc.7b02072. [17] T. Pintauer, Chem. Pap. 2016, 70, 22. doi: 10.1515/chempap-2015-0183.[18] G. Song, F. Wang, X. Li, Chem. Soc. Rev. 2012, 41, 3651. doi: 10.1039/C2CS15281A. [19] J. Oxgaard, W. J. Tenn, R. J. Nielsen, R. A. Periana, W. A. Goddard, Organometallics, 2007, 26, 1565. doi: 10.1021/om061189b. [20] L. Ackermann, Chem. Rev. 2011, 111, 1315. doi: 10.1021/cr100412j. [21] T. Rogge, J. C. A. Oliveira, R. Kuniyil, L. Hu, L. Ackermann, ACS Catal. 2020, 10, 10551. doi: 10.1021/acscatal.0c02808. [22] D. Gallego, E. A. Baquero, Open Chem. 2018, 16, 1001. doi: 10.1515/chem-2018-0102. [23] L. Wang, B. P. Carrow, ACS Catal. 2019, 9, 6821. doi: 10.1021/acscatal.9b01195.
反应实例
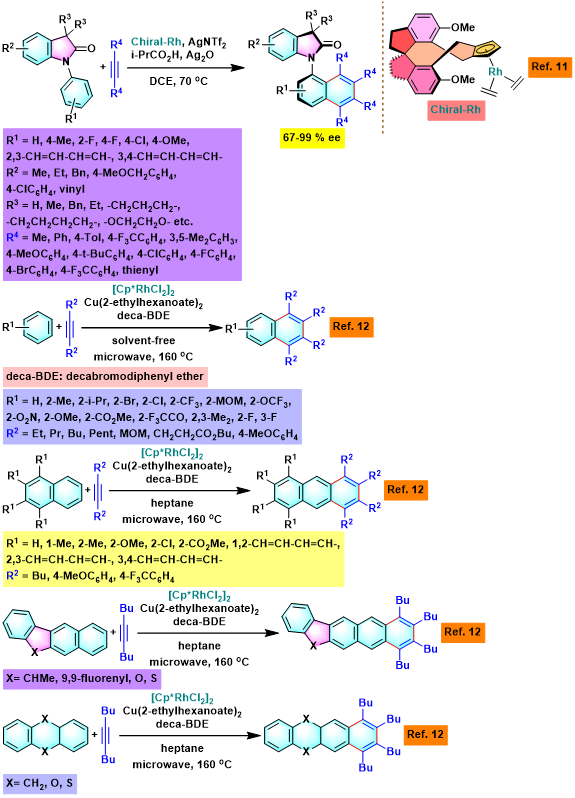
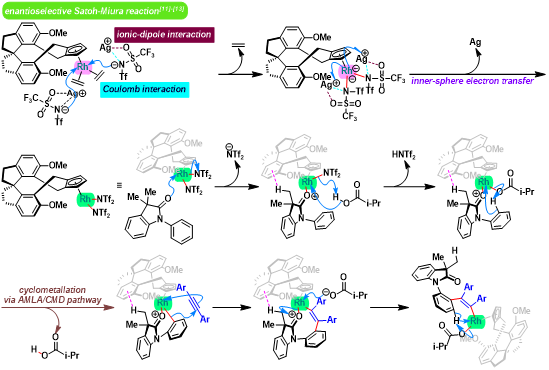
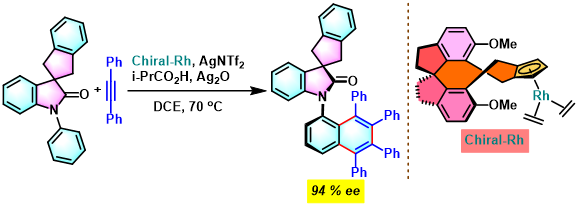
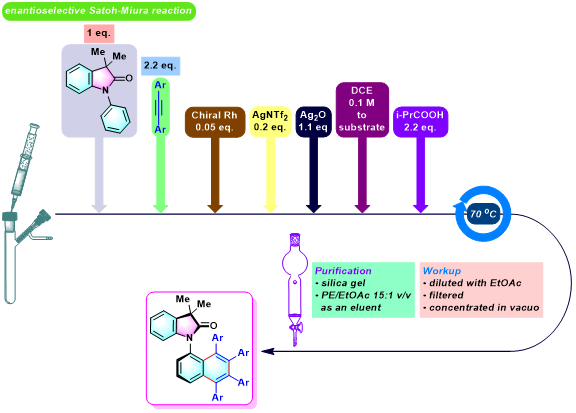
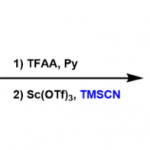
C-N轴手性N-芳基羟吲哚的合成[1]
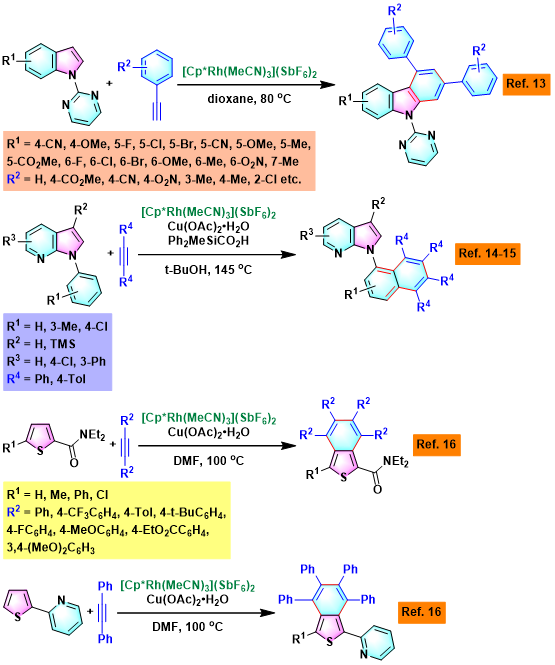
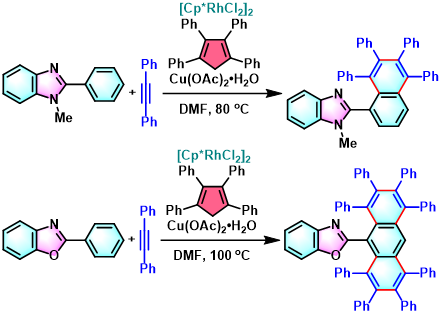
2-萘基苯并咪唑与2-(1,2,3,4,5,6,7,8-八苯基蒽-9-基)苯并噁唑的合成[2]
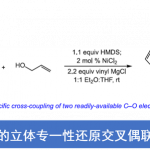
2-苯基苯酚的芳香同系化[3]
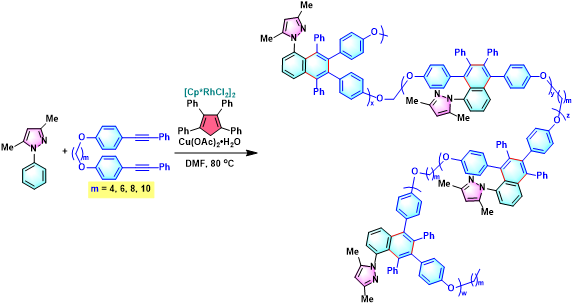
聚(吡唑基萘)的合成[4]
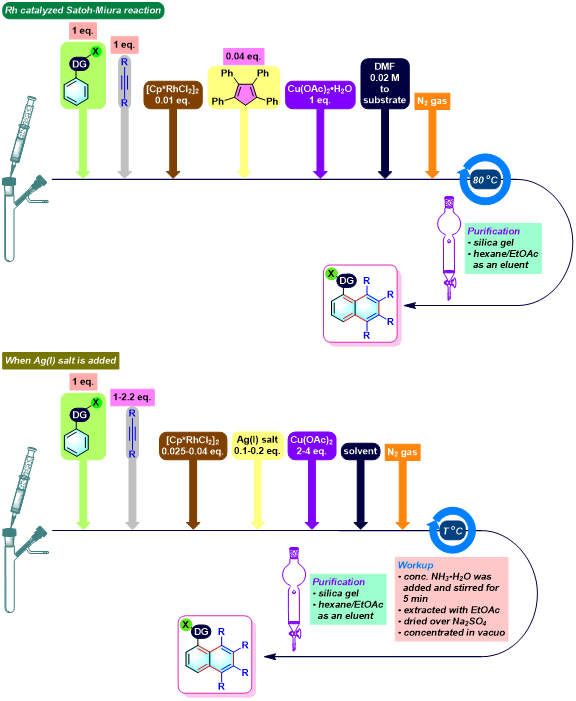
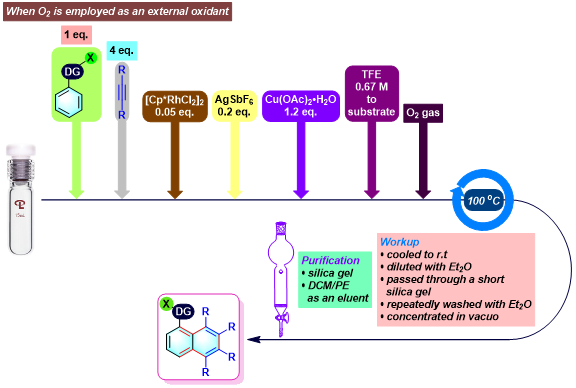
实验步骤









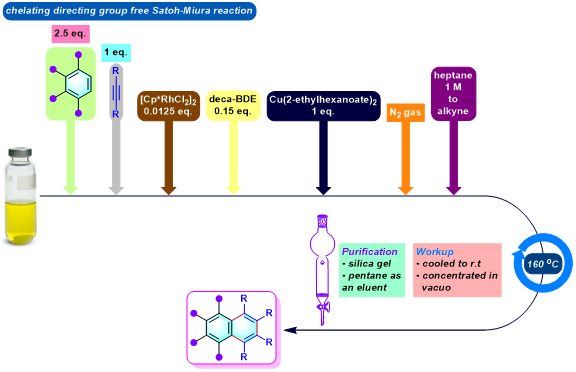
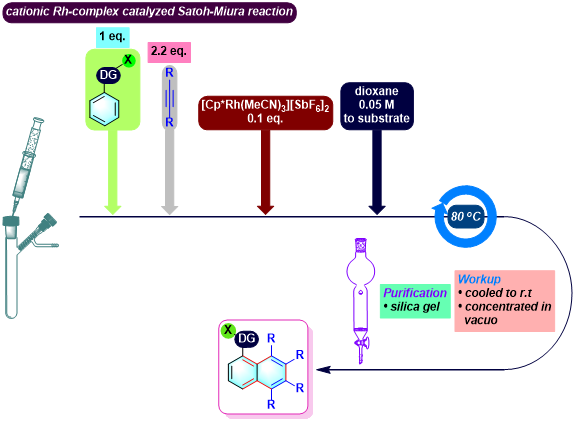
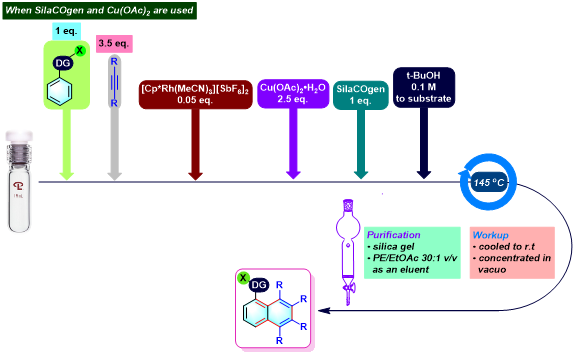














No comments yet.