本文作者:孙苏赟
第一部分 KMnO4法,Prévost反应和Sharpless AA
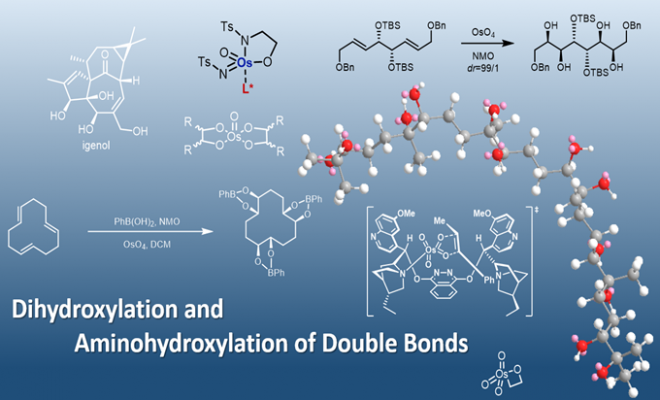
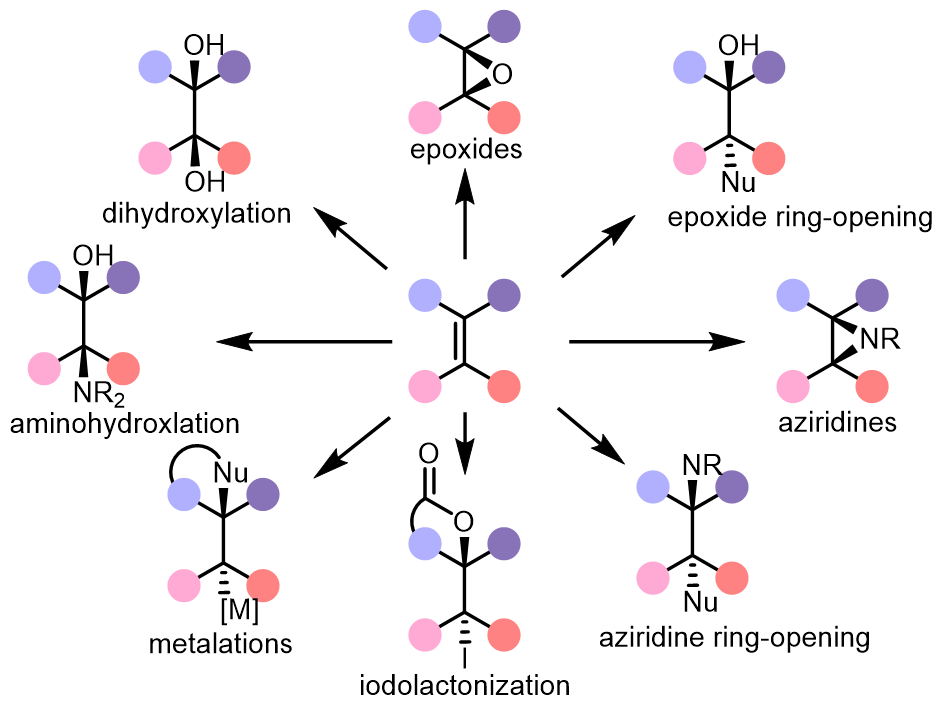
双键中相对丰富的π电子使其非常容易被氧化和与其他亲电试剂反应,例如环氧化,双羟基化,氮丙啶化,氨基羟基化等:
这里介绍的是几种常见的双羟化和胺羟化的方法。
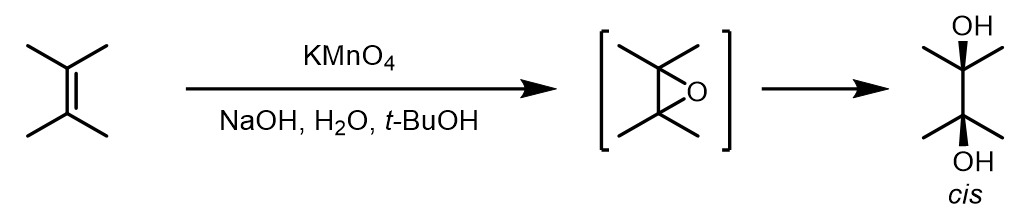
1.KMnO4氧化
KMnO4氧化得到的产物是立体专一的顺式加成产物,但是一般来讲产率都很低,而且不如锇试剂温和。当反应在碱性条件下,会使得碳碳单键的断裂,因此一般会在酸性或中性条件下进行反应。
这里是一个例子:[1]
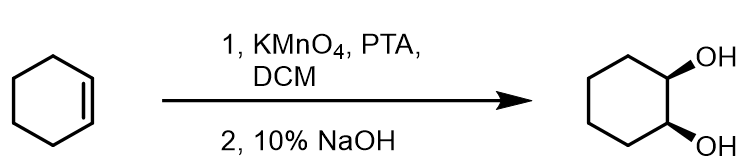
此外还有另外一种经理环氧中间体的间接法:
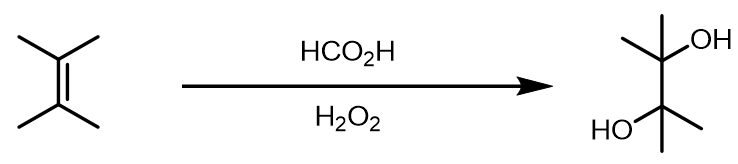
这个反应得到的是反式加成的产物,经历的是环氧化物的中间体,再进行水解开环。
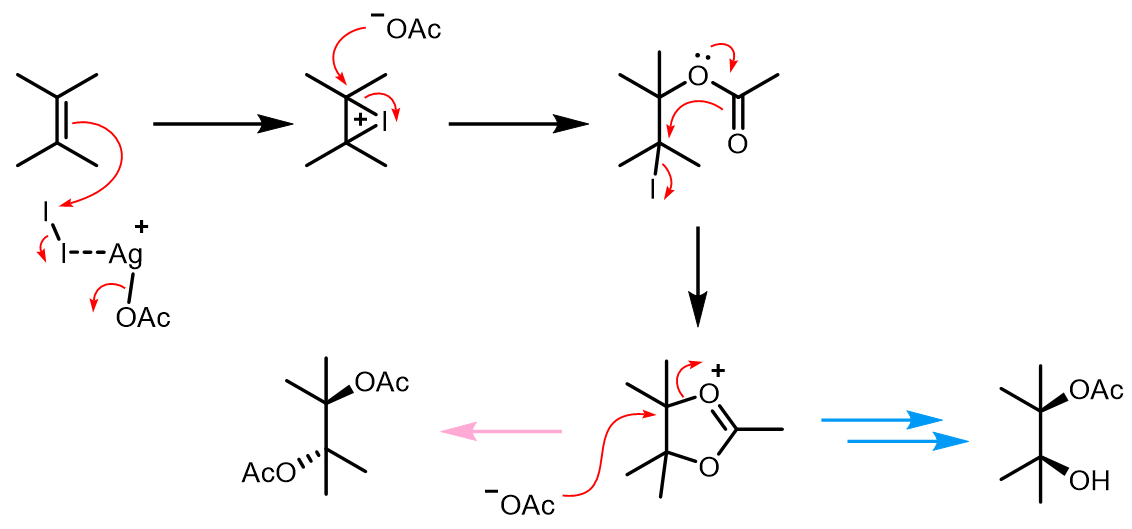
2. Prévost反应
可以通过反应条件控制产物的立体选择性:
这个反应需要无水的条件,右边的反应也称Prévost-Woodward反应,因为Woodward的改进使得反应可以再很大位阻的双键上发生反应得到顺式加成的产物。反应的机理如下:
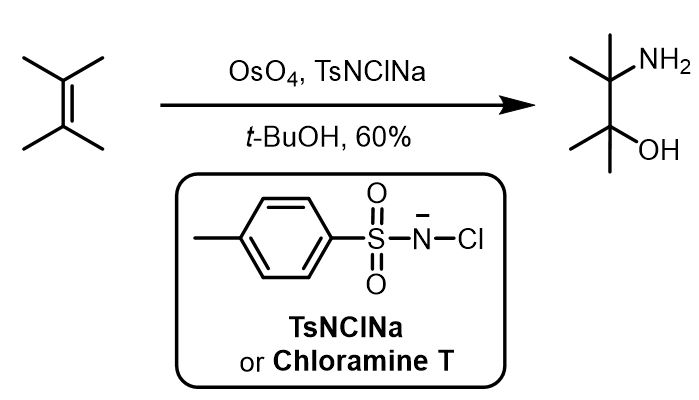
3.不对称胺基羟基化反应 (Sharpless Asymmetric Aminohydroxylation, Sharpless AA)
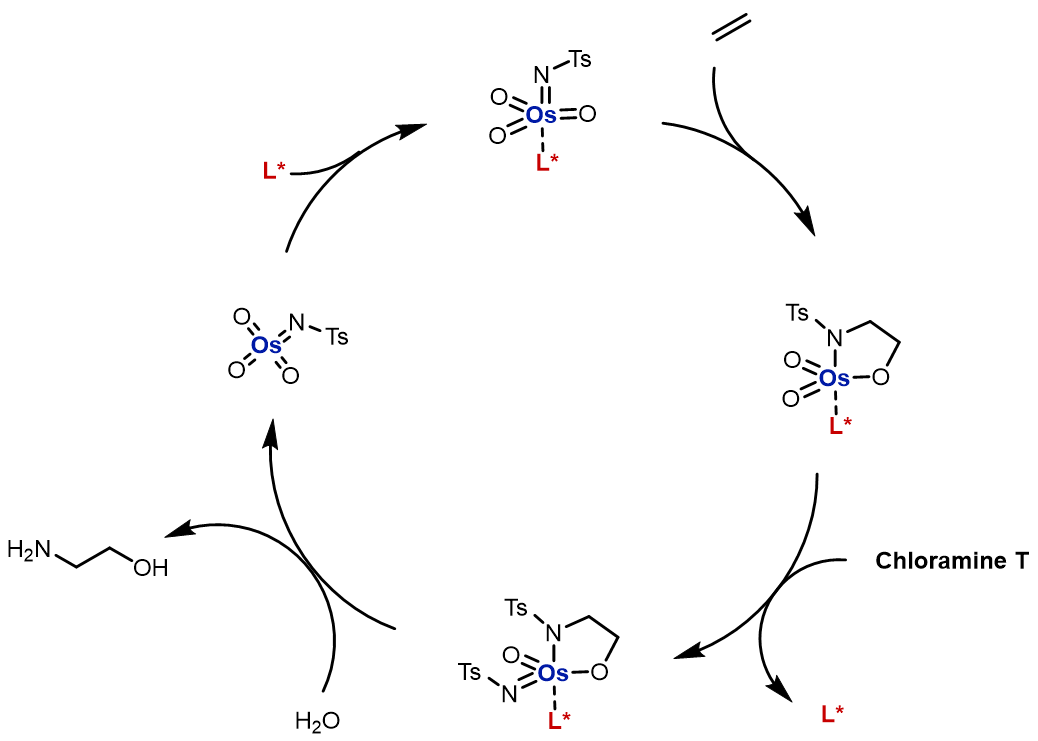
反应过程中,chloramine T是反应的主要试剂,可以讲锇试剂氧化成为含氮试剂:
相同地,这个反应是立体专一的顺式加成,但是生成的黄酰胺很稳定,比较难发生裂解,可以用还原剂或者其他更加强烈的条件后处理。反应的机理:
几个例子:
(1) 一个缺电子双键体系的反应:[2]
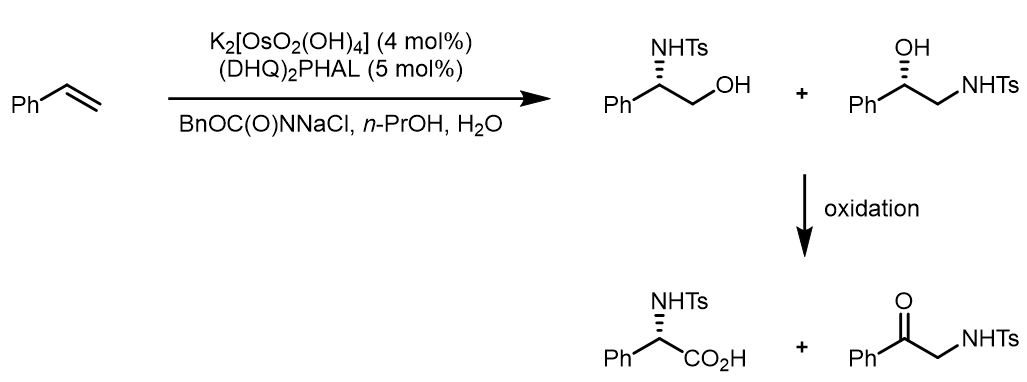
(2) 得到的醇化合物可以很容易的进行后续的氧化:[3]
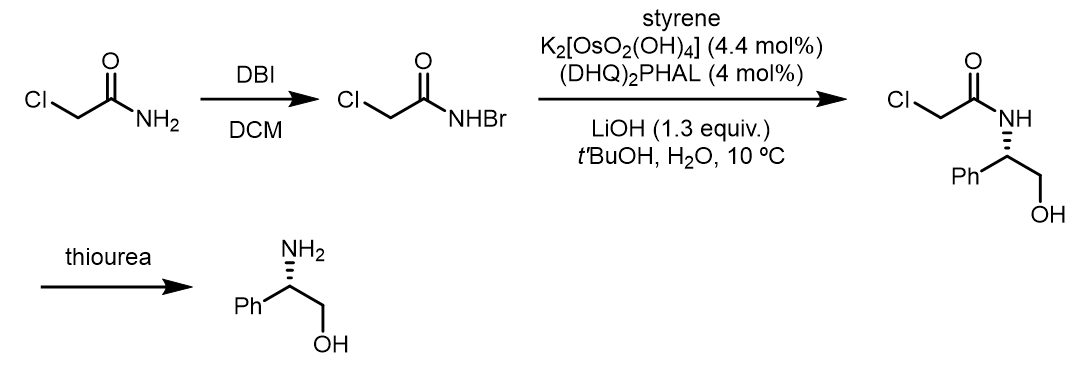
(3) α-氯代溴代酰甲胺作为氮源:[4, 5]
References
- [1] Synthesis, 1984, 1984(5), 431-433, DOI: 10.1055/s-1984-30865
- [2] Angew. Chem. Int. Ed., 1996, 35, 451. DOI: 10.1002/anie.199604511
- [3] J. Am. Chem. Soc.1998, 120, 6, 1207-1217. DOI: 10.1021/ja9728177
- [4] Org. Lett. 1999, 1, 5, 783-786. DOI: 10.1021/ol990761a
- [5] Org. Lett. 2000, 2, 15, 2221-2223. DOI: 10.1021/ol000098m
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.