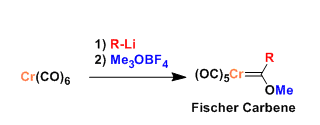
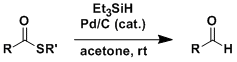羧酸衍生物 → 醛
- 概要
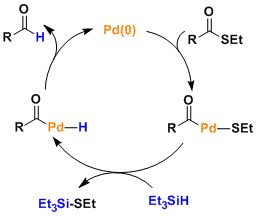
福山还原反应是由羧酸出发容易得到的硫酯,不经过醇这一步的情况下直接还原成醛。反应在非常温和的条件下进行,对于取代基的一般性,选择性也非常高。
经过较少步骤将氧化态的羧酸还原到对应的醛,这中手法在当下仍是不常见,因此本反应在有机合成当中也是一个很重要有用的手法。
- 基本文献
・Fukuyama, T. Lin, S.-C.; Li, L.J. Am. Chem. Soc. 1990, 112, 7050. DOI: 10.1021/ja00175a043
・Tokuyama, H.; Yokoshima, S.; Yamashita, T.; Lin, S.-C.; Li, L.; Fukuyama, T. Synthesis 2002, 1121. DOI: 10.1055/s-2002-31969
・福山透, 有機合成化学協会誌 2003, 61, 620.
・Fukuyama, T.; Tokuyama, H. Aldrichimica Acta 2004, 37, 85. [PDF]
- 反应机理
- 反应实例
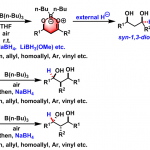
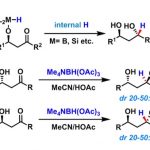
胺,酯,酮,缩醛,硅基保护基团,硫醚,β内酰胺等等不适用于本反应。烯也会被还原,但是能用Lindlar催化剂加过量端位烯对反应进行改良[1]从而避免。
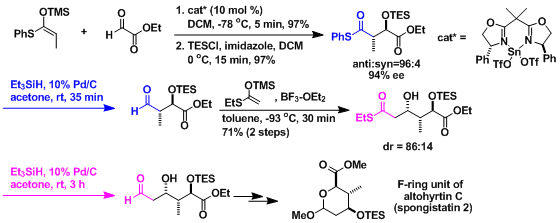
由于官能团适用范围广,选择性高,条件温和,本反应在天然物合成领域时常会被用到。
altohyrtin C (spongistatin 2)的合成[2]:催化不对称向山aldol反应与本反应联用,能达到连续得到不对称中心的高效率合成。
- 实验步骤
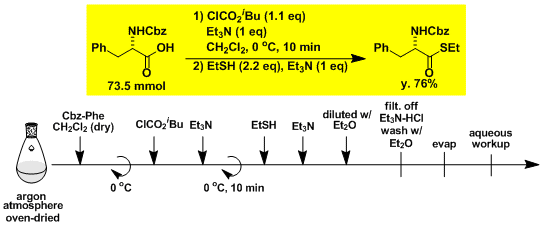
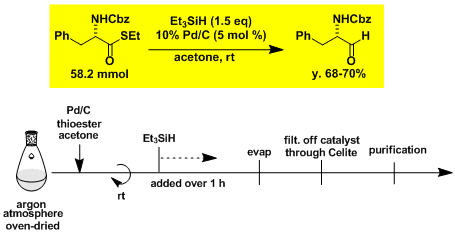
α-氨基酸→α-氨基醛的2步合成[3]
STEP 1
STEP 2
- 实验技巧
- 参考文献
[2] Evans, D. A. et al. Tetrahedron 1999, 55, 8671. doi:10.1016/S0040-4020(99)00438-X
[3] Tokuyama, H.; Yokoshima, S.; Yamashita, T.; Lin, S.-C.; Li, L.; Fukuyama, T. Synthesis 2002, 1121. DOI: 10.1055/s-2002-31969