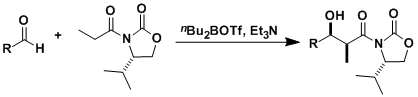- 概要
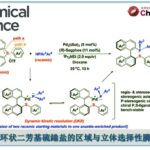
手性噁唑烷酮作为助剂与醛反应,实现不对称羟醛反应的手法。最流行的是使用苯丙氨酸或是缬氨酸变化得到的助剂。
必须使用摩尔当量的手性助剂,辅助基团的引入脱去步骤等是反应的不足之处。但是反应的可信度非常之高,有很多的优势。尤其”Evans-syn”合成法使用三氟甲磺酸二正丁基化硼几乎从未发现选择性出现差异,几乎完美实现立体选择性的碳碳键生成。由于反应能实现大量合成,频繁被用于不对称全合成的开始阶段。
在天然产物合成领域,尤其是链状分子,大环内酯类化合物的合成领域,几乎是一定被用到的非常有用的合成方法。
- 基本文献
・Evans, D. A.; Vogel, E.; Nelson, J. V. J. Am. Chem. Soc. 1979, 101, 6120. DOI:10.1021/ja00514a045
・Evans, D. A.; Bartroli, J.; Shih, T. L. J. Am. Chem. Soc. 1981, 103, 2127. DOI: 10.1021/ja00398a058
・Evans, D. A. Aldrichimica Acta 1982, 15, 23.
・Kim, B. M. et al. Comp. Org. Syn. 1991, 2, 239.
・Review: Evans, D. A. et al. Actualité Chimique, 2003, 35.
- 反应机理
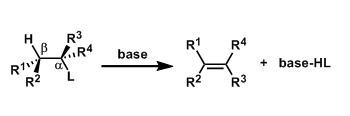
被三氟甲磺酸二正丁基化硼(一种路易斯酸)活化的酰亚胺α位的氢被三乙胺摘去,生成Z体的烯醇硼盐。烯醇硼盐与醛基形成六元环的过渡态,从而得到syn体的产物。手性基团能避免两个羰基的互斥,中间体如图所示。(参考:J. Am. Chem. Soc. 1981, 103, 3099) 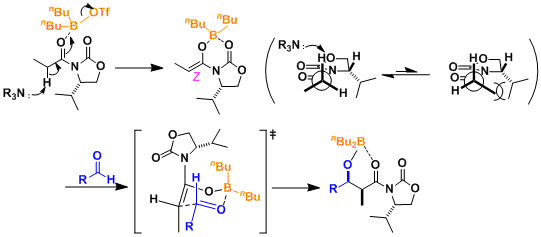
- 反应实例
已被报道的通过变换路易斯酸和手性助剂的组合,所有能够设想的埃文斯羟醛反应产物都能被得到。这些立体选择性的改变是由于六元环过渡状态的不同[1][2][3]。即由于辅助基团以及金属配位数(螯合能)的不同,辅助基团的立体配位会不同。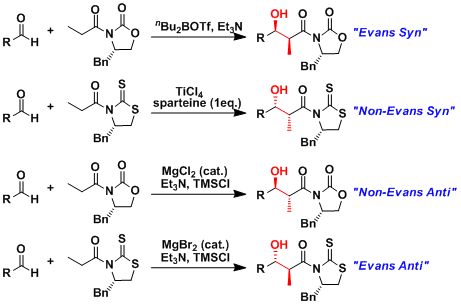
噁唑烷酮辅助基团可以通过反应变换成各种官能团。尤其是变换成Weinreb酰亚胺之后非常有应用价值。 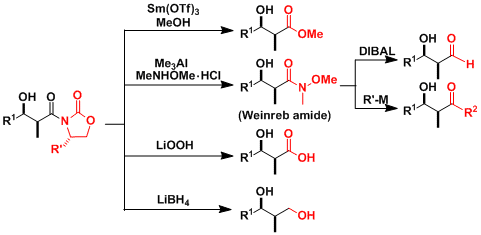
- 实验步骤
- 实验技巧
- 参考文献
[2] “Non-Evans Anti” & “Evans Anti”: Evans D.A.; Tedrow J.S.; Shaw J.T.; Downey C.W.; J. Am. Chem. Soc. 2002, 124, 392. doi: 10.1021/ja0119548