作者:漂泊
锇是一种稀有的铂系金属,它可以用于制造应用于钢笔尖及圆珠笔尖的硬质合金。同时也可以作为催化剂——锇是合成氨工业的第一代催化剂,具有重要的里程碑意义。除此之外,四氧化锇也是一种重要的氧化剂,可以催化烯烃的氧化,是有机反应中重要的氧化试剂。此外,它也能用于指纹检测。
锇的基本物理性质
| 分类 | 第Ⅷ族·金属 |
| 原子序号・原子量 | 76 (190.23) |
| 电子配置 | 5d66s2 |
| 密度 | 22.59 g/cm 3 |
| 熔点 | 3045 oC |
| 沸点 | 5012 oC |
| 色・形状 | 灰蓝色金属 |
| 丰度 | 0.0015 ppm(地壳) |
| 发现者 | Smithson Tennant, William Hyde Wollaston |
| 主要的同位素 | 184Os, 186Os, 187Os, 188Os, 189Os, 190Os, 192Os |
| 用途例 | 笔尖、催化剂、氧化剂 |
| 前后的元素 | 铼-锇-铱 |
锇的发现
锇在1803年由Smithson Tennant 和William Hyde Wollaston发现。17世纪晚期,在一个哥伦比亚的银矿中,人们发现了一种“铂金”,研究人员用王水将这种新发现的“铂金”溶解以获得的它的可溶盐,但是总是有少量的黑色不溶物残留。Joseph Louis Proust认为残留物是石墨。1803年,Victor Collet-Descotils,AntoineFrançois,comte de Fourcroy和Louis Nicolas Vauquelin在铂金溶解的黑色残留物中发现了铱,但是没有获得足够的材料进行进一步的实验。同年,Smithson Tennant也分析了“铂金”用王水溶解后剩下的不溶性残留物并认为其中含有一种未发现的新元素。Vauquelin用碱和酸交替溶解残渣并得到一种挥发性新氧化物,他用希腊语πτηνος(ptènos)(希腊文中意为“易挥发”)将这种新金属命名为ptene,。Smithson Tennant拥有很多的残留物,他进一步进行了研究,他将残留物与氢氧化钠在红热状态下反应得到了一种黄色溶液(可能是cis- [Os(OH)2O4]2-)。酸化蒸馏后他得到了OsO4。OsO4的熔点只有41℃,易挥发,并且具有刺激性气味,于是Smithson Tennant根据希腊文osme,原意是“臭味”,将这种新元素命名为Osmium(锇),元素符号定为Os。[1-9]

金属锇
钢笔尖
锇是一种的很稀少的金属,它一般是以合金的形式使用。尽管储量并不多,但含有锇的产品在我们的生活中还是非常常见的——如钢笔尖。锇常用来加工坚硬的合金,铱锇合金是其中非常重要的一种。铱锇合金常用于一些高磨损应用,如钢笔尖和圆珠笔尖以及仪器的轴承。它能抵抗频繁操作所造成的磨损。锇合金尖端相比于铬合金尖端而言,更为耐用。[10]

含有铱锇合金的钢笔尖
合成氨初代催化剂
除了用于加工硬质合金,锇也是一种重要的催化剂。它是合成氨的第一代催化剂。19世纪之前,农业上所需要的氮肥主要来自粪便以及用储量有限的硝石。随着农业生产效率的提升,氮肥的需求量也越来越大。依靠硝石和粪便生产的氮肥已经不能满足需要,开拓新的氮肥来源途径迫在眉睫。科学家们开始寄希望于大气固氮,即将大气中的氮气与氢气反应合成氨,再制造成化肥。
合成氨的工业化一直以来都是一个艰难的课题。人类从第一次尝试合成氨到工业化投产,花费了约150年的时间。在19世纪下半叶,随着物理化学的巨大进展,研究人员意识到由氮气和氢气合成氨的过程是可逆的,增加压力可以促进反应的进行,降低温度也有同样的效果,但是降低温度的同时也会降低反应速率,这就使得研究增快合成氨反应速率的催化剂显得越发重要。德国化学家哈伯在该领域做出了卓越的贡献,他利用水煤气反应制得了氢气,并除去了二氧化碳副产物,同时除去空气中的氧气制得了氮气。接下来他通过不断实验尝试和计算,终于获得较为理想的反应条件。在600 oC,200个大气压,以锇作为催化剂的条件下,能够得到产率为8%的氨气。再通过将氨气分离出反应体系,促进平衡向合成氨的方向移动,就可以大大提升原料的利用效率。这种方法就被成为哈伯合成氨法。
锇催化剂在这个过程中起到了非常重要的作用。但是由于锇储量稀少,价格高昂,且易被氧化,因此被逐渐淘汰了。但是锇作为合成氨的第一代催化剂,具有重要的里程碑意义。合成氨工业的实现使得化肥的大规模生产成为可能,使得世界产量大幅提高,拯救了无数处于饥饿边缘的人的生命。哈伯也因在合成氨领域所作出的卓越贡献而获得了诺贝尔化学奖。[11]

德国化学家Fritz Haber
四氧化锇
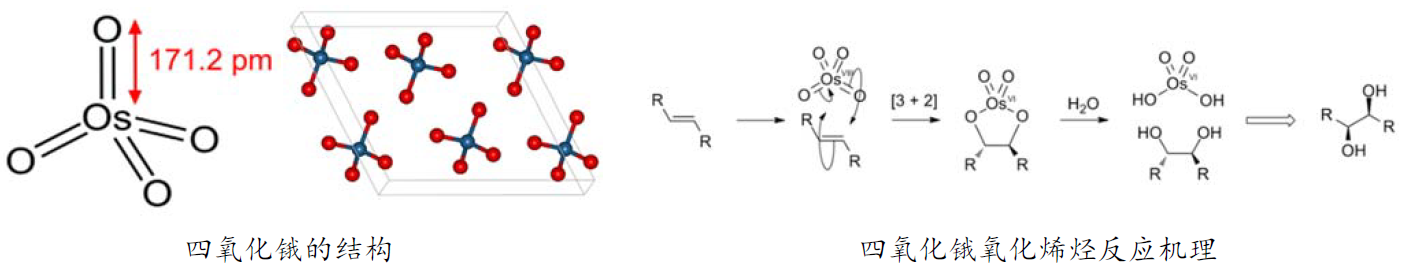
四氧化锇是一种具有刺激性气味的易挥发固体,熔点为41oC,该化合物时无色的,但由于四氧化锇中通常混有少量的二氧化锇,因而呈现黄色。四氧化锇是一种很强的氧化剂,它可以直接将烯烃氧化为邻位二醇。通四氧化锇和烯烃之间的[3 + 2] 环加成反应形成鎓离子,再水解就形成了邻位二醇。但是由于四氧化锇昂贵且有剧毒,因此未能广泛使用。
四氧化锇也用于指纹检测,作为强氧化剂,它主要通过与不饱和碳-碳键反应交联脂质,从而将生物膜固定在组织样品中并在同时将它们染色。由于锇原子的电子密度极高,因此锇染色会极大地增强生物材料在透射电子显微镜(TEM)下的图像衬度。否则那些碳材料将只会有非常弱的TEM衬度。 [12-15]
参考文献
- [1] Venetskii, S. I. (1974). “Osmium”. Metallurgist. 18 (2): 155–157. doi:10.1007/BF01132596.
- [2] McDonald, M. (959). “The Platinum of New Granada: Mining and Metallurgy in the Spanish Colonial Empire”. Platinum Metals Review. 3 (4): 140–145.
- [3] Hunt, L. B. (1987). “A History of Iridium”. Platinum Metals Review. 31 (1): 32–41. Retrieved March 15, 2012.
- [4] Haubrichs, Rolf; Zaffalon, Pierre-Leonard (2017). “Osmium vs. ‘Ptène’: The Naming of the Densest Metal”. Johnson Matthey Technology Review. 61 (3): 190. doi:10.1595/205651317×695631.
- [5] Emsley, J. (2003). “Osmium”. Nature’s Building Blocks: An A-Z Guide to the Elements. Oxford, England, UK: Oxford University Press. pp. 199–201. ISBN 978-0-19-850340-8.
- [6] Griffith, W. P. (2004). “Bicentenary of Four Platinum Group Metals. Part II: Osmium and iridium – events surrounding their discoveries”. Platinum Metals Review. 48 (4): 182–189. doi:10.1595/147106704X4844.
- [7] Thomson, T. (1831). A System of Chemistry of Inorganic Bodies. Baldwin & Cradock, London; and William Blackwood, Edinburgh. p. 693.
- [8] Weeks, M. E. (1968). Discovery of the Elements (7 ed.). Journal of Chemical Education. pp. 414–418. ISBN 978-0-8486-8579-9. OCLC 23991202.
- [9] Tennant, S. (1804). “On Two Metals, Found in the Black Powder Remaining after the Solution of Platina”. Philosophical Transactions of the Royal Society. 94: 411–418. doi:10.1098/rstl.1804.0018. JSTOR 107152.
- [10] Cramer, Stephen D. & Covino, Bernard S. Jr. (2005). ASM Handbook Volume 13B. Corrosion: Materials. ASM International. ISBN 978-0-87170-707-9.
- [11] http://www.360doc.com/content/16/0517/23/253213_560014840.shtml
- [12] MacDonell, Herbert L. (1960). “The Use of Hydrogen Fluoride in the Development of Latent Fingerprints Found on Glass Surfaces”. The Journal of Criminal Law, Criminology, and Police Science. 51 (4): 465–470. doi:10.2307/1140672. JSTOR 1140672.
- [13] Bozzola, John J.; Russell, Lonnie D. (1999). “Specimen Preparation for Transmission Electron Microscopy”. Electron microscopy : principles and techniques for biologists. Sudbury, Mass.: Jones and Bartlett. pp. 21–31. ISBN 978-0-7637-0192-5.
- [14] Cotton and Wilkinson,Advanced Inorganic Chemistry,p.1002
- [15] Thompson, M. “Osmium tetroxide (OsO4)”. Bristol University. Retrieved 2012-04-07.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!

























No comments yet.