本文投稿作者 漂泊
钴元素是一种非常重要的金属元素,它在电镀、玻璃、染色、医药医疗等方面有着广泛的用途。钴元素被称为“工业的维生素”,很多重要合金都含有钴;而钴酸锂是目前最为重要正极材料;此外钴蓝则是一种重要的染料;钴胺素则作为辅酶,在生物体的代谢活动中发挥着重要的用途……
钴的基本物理性质
| 分类 | 过渡金属 |
| 原子序号・原子量 | 58.9332 |
| 电子配置 | 3d74s2 |
| 密度 | 8900kg / m 3 |
| 熔点 | 1495°C |
| 沸点 | 2870°C |
| 色・形状 | 银白色金属 |
| 丰度 | 20ppm(地壳)0.0000069(ppm)(海水) |
| 发现者 | G.Brandt |
| 主要的同位素 | 56Co, 57 Co, 58Co, 59 Co, 60Co |
| 用途例 | 磁性材料、锂电池正极、颜料 |
| 前后的元素 | 铁-钴-镍 |
钴的发现
钴是一种使用历史非常悠久的元素,古代希腊人和罗马人曾用钴的化合物来制造深蓝色的玻璃,中国唐代的彩瓷上鲜艳的蓝色也来源于钴的化合物,人们称这种美丽、神奇的染料为钴蓝。在埃及,图坦卡蒙的墓中也发现了含钴的蓝色玻璃,这些都证明了人们早在很久以前就开始使用钴的化合物了。
钴元素的发现得追溯到数百年之前,在德国的萨克森州,有一个规模很大的金属矿,在这里,矿工们发现了一种外表很像银的矿石,他们认为这是一种非常有价值的矿石,于是大量开采冶炼。但是在冶炼过程中,经常会发生二氧化硫、砷毒气中毒等事故,他们认为这是恶魔作祟,于是便在教堂里诵读祈祷文,替工人解脱恶魔迫害。这个“恶魔”的源头其实是辉钴矿,因为这个缘故,于是钴元素便无辜的获得了“kobalt”这个“恶魔”意思的名字,并沿用至今。[1]
1753年,瑞典化学家格•布兰特(G.Brandt)从辉钴矿中分离出浅玫色的灰色金属,这是第一次制得纯度较高的金属钴。之后,在1780年,瑞典化学家伯格曼(T.Bergman)又制得了纯钴,并确定钴是一种新的金属元素。1789年,拉瓦锡将这种元素首次列入了元素周期表。
钴单质
颜料中的钴
钴元素的许多化合物都具有非常鲜艳的色彩,如粉红的氯化钴,玫红的硫酸钴,浅红的草酸钴……钴元素不仅仅是制造合金的“工业维生素”,同时也是制备各种高级颜料的重要原材料。钴蓝是最为著名的蓝色颜料,钴蓝的化学组成是CoO•Al2O3即铝酸钴,矿物组成是Co•Al2O4,即钴铝尖晶石。钴蓝颜料有鲜明的色泽,着色强度很高,还有极强的耐热性、耐酸碱性,它被广泛用于陶瓷、玻璃等饰品的上色。在中世纪时,威尼斯的能工巧匠们曾用钴蓝染料制作了精美绝伦的蓝色玻璃杯,风靡世界各国。在中国,明代年间生产的景泰蓝使用的也是钴蓝染料,这种美丽的瓷器也远销海外,在世界范围内都有着美好的声誉。钴蓝染料的成分一度是一个谜,威尼斯工匠为了防止钴蓝的配方泄露,甚至还将整个玻璃生产工厂搬迁到了一个孤零零的小岛上,来杜绝情报泄露。根据17世纪保存下来的文件记载,沙俄为了购买昂贵的钴蓝颜料曾花费了巨额资金,俄国人称这种颜料为“戈卢贝茨”,“蓝色”之意。克里姆林宫的大厅和安眠大教堂等许多宏伟大厦的墙壁都涂有这种美丽的蓝色染料。[2]
除了钴蓝染料,钴的化合物也被用来制作其他颜色的颜料,如CoLiPO4紫色颜料以及(Fe, Co)Fe2O4和(Co, Fe)(Fe, Cr)2O4两种黑色颜料。[3]
此外,钴元素还有一些化合物,它们在不同状态和温度时,会具有变化莫测的颜色。据记载,16世纪著名的医生帕拉塞尔萨斯常爱表演他的拿手戏法,每次都博得看客的热烈掌声。他先把一幅上面画有覆盖着积雪的树木和小山的冬季风景的油画拿给观众看,待他们欣赏够了之后,他就在众目睽暌之下把油画中的冬天“变成”了夏天:树上的积雪一下不见了,变成了成簇的绿叶;白色积雪的山丘则变成了长满绿草的山坡。观众无不赞叹,可就是不知其中的奥秘。其实,这只是利用氯化钴变的一个魔术。在室温下,氯化钴可以制成一种白色的溶液(溶液中含有一定数量的镍和铁),帕拉塞尔萨斯就用这种溶液作画,在画干了后,只要稍微加热,氯化钴就会变成非常漂亮的绿色。帕拉塞尔萨斯表演时,先把氯化钴溶液涂在他的魔画上,然后趁观众欣赏画面而没有注意他的瞬间,麻利地将一支蜡烛悄悄地放在油画背后加热它,于是,氯化钴受热后就变成绿色,使人目瞪口呆的季节变化也就发生了。[4]
钴蓝、钴紫、钴黑染料;钴蓝玻璃;景泰蓝;钴蓝玻璃杯
重要的正极材料——钴酸锂
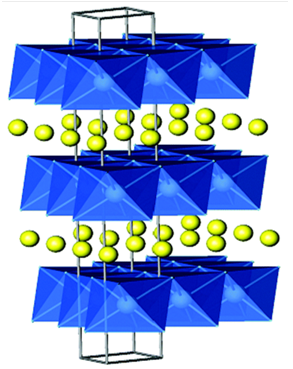
目前,钴酸锂是使用范围最广,消耗量最大的锂电池正极材料,钴酸锂是是一种具有层状结构的材料,它的层状结构主体由[CoO6]八面体组成,[CoO6]八面体层与层之间具有Li离子的位点,Li离子全满时占据了六方密排面的所有位点,六方结构的a,b轴长度为2.8138 Å,c轴为14.0516Å,属于R-3m空间群SG166。当发生充放电时,锂离子发生可逆的嵌入/脱嵌反应:
充电:LiCoO2——>xLi++Li1-xCoO2+xe–
放电:Li1-xCoO2+xe–+xLi+——>LiCoO2
目前以钴酸锂为正极的的锂离子电池具有开路电压高,比能量高(理论比能量1068kW▪h,理论容量274mAh▪g-1)循环寿命长、能快速充放电的特点,但由于钴价格较高,所以成本较为高昂。钴酸锂具有三种不同的相,分别是层状结构、尖晶石结构和岩盐结构,锂离子电池中应用最多的是层状结构的钴酸锂。
LiCoO2结构示意图[5]
用途广泛的钴合金
钴单质是一种非常神奇的金属,它具有非常优异的物理化学性质,它具有磁化一次就能保持磁性的特性。由于钴优越的磁特性,被大量应用于高性能磁性材料的制造,它是永久磁性合金最为重要的组成部分。磁性材料是重要的功能材料,在电子工业和高科技领域起着非常重要的作用。而且钴在几种具有磁性的金属当中具有最高的居里点。(在热作用下,失去磁性的温度叫居里点。铁的居里点为769℃,镍为358℃,而钴可达1150℃。)
钴合金具有非常好的韧性及耐磨性,钴将合金组成中其他金属碳化物晶粒结合在一起,使合金具更高的韧性,并能减少对冲击的敏感性能。添加一定量钴的钢材,其耐磨性和切削性能可显著提高;将钴合金熔焊在零件表面,可使零件的寿命提高3-7倍。钴合金不仅具有很好的韧性,也具备很强的耐热性,它的耐热性是因为形成了难熔的碳化物,这些碳化物不易转为固体溶体,扩散活动性小。含钴50%以上的司太立特硬质合金即使加热到1000℃也不会失去其原有的硬度,显示了非常优越的耐热性能。在航空涡轮机的结构材料使用含20%~27%铬的钴合金,可以不要保护覆层就能使材料达高抗氧化性。由于钴合金优异的性质,各种各样的钴合金也被广泛用于燃汽轮机的叶片、叶轮、喷气发动机、火箭发动机、导弹的部件以及化工设备中各种高负荷的耐热部件。[6-7]
钴合金磁性材料发动机叶轮
钴的生理功能
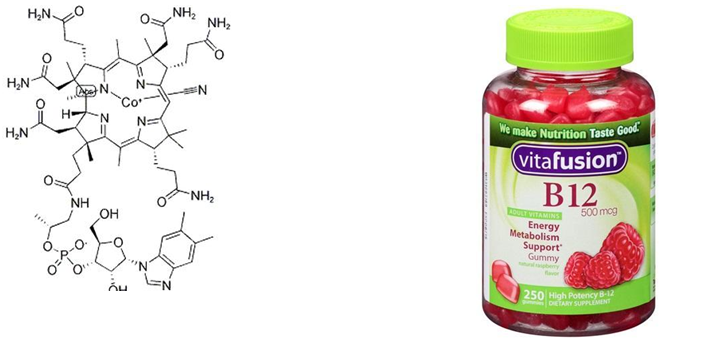
钴胺素,又称维生素B12,它是唯一一种含金属元素的维生素。钴胺素是一种含有3价钴的多环系化合物,4个还原的吡咯环连在一起变成为1个咕啉大环(与卟啉相似),钴是维生素B12分子的核心。维生素B12为浅红色的针状结晶,易溶于水和乙醇,在pH值4.5~5.0弱酸条件下最稳定,强酸(pH<2)或碱性溶液中分解,遇热可有一定程度破坏,遇强光或紫外线易被破坏。反刍动物可以在肠道内将摄入的钴合成为维生素B12,而人类与单胃动物则不能将钴在体内合成B12,只能从外界摄取。目前已观察到无机钴对刺激红细胞生成有重要的作用。钴对红细胞生成作用的机制是影响肾释放促红细胞生成素,或者通过刺激胍循环。如果缺乏钴,将可能导致恶性贫血。维生素B12还可促进蛋白质的生物合成,缺乏时会影响婴幼儿的生长发育。[8]
钴元素能刺激人体骨髓的造血系统,促使血红蛋白的合成及红细胞数目的增加。大多以组成维生素B12的形式参加体内的生理作用。钴刺激造血的机制为:①通过产生红细胞生成素刺激造血。钴元素可抑制细胞内呼吸酶,使组织细胞缺氧,反馈刺激红细胞生成素产生,进而促进骨髓造血。②对铁代谢的作用。钴元素可促进肠粘膜对铁的吸收,加速贮存铁进入骨髓。③通过维生素B12参与核糖核酸及造血物质的代谢,作用于造血过程。④钴元素可促进脾脏释放红细胞(血红蛋白含量增多,网状细胞、红细胞增生活跃,周围血中红细胞增多),从而促进造血功能。[8]
微量的钴元素是人体必不可少的,但大量的钴也可能导致人体中毒,如钴尘可能引起“硬质合金病”,表现为过敏性哮喘,呼吸困难、干咳、间质性肺炎以及肺水肿,因此需要格外注意。[9]
钴胺素结构示意图维生素B12补品
参考文献
[1]Dennis, W. H (2010). “Cobalt”. Metallurgy: 1863–1963. pp. 254–256. ISBN 978-0-202-36361-5. [2]Cobalt, Encyclopædia Britannica Online. [3]Witteveen, H. J.; Farnau, E. F. (1921). “Colors Developed by Cobalt Oxides”. Industrial & Engineering Chemistry. 13 (11): 1061–1066. doi:10.1021/ie50143a048 [4]http://baike.asianmetal.cn/metal/co/history.shtml [5]Whittingham M S. Lithium batteries and cathode materials[J]. Chemical reviews, 2004, 104(10): 4271-4302. [6]Donachie, Matthew J. (2002). Superalloys: A Technical Guide. ASM International. ISBN 978-0-87170-749-9. [7]《生物化学原理》(第二版),杨荣武,高等教育出版社,2012,9 [8]陈国生.钴对人类的危害性[J].世界医学信息 1989; 4(5):135.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!





























No comments yet.