本文作者:杉杉
导读
近日,贵州医科大学赵永龙课题组在绿色化学(GreenChemistry)杂志上发表论文,首次报道了使用KI作为催化剂,H2O2作为绿色氧化剂,在室温条件下反应,实现吲哚-3-酮与羧酸底物的直接酰氧基化反应,获得多种C2-取代的酰氧基吲哚-3-酮衍生物(收率高达96%)。此外,该产物可作为合成亲核性2-单芳基吲哚-3-酮和3-亚烷基吲哚的通用中间体。
Direct C(sp3)-H Acyloxylation ofIndolin-3-ones with Carboxylic Acids Catalysed by KI
Yong-Long Zhao,Yong-Qin Tang, Xing-Hai Fei, Fen-Fen Yang, Zhuo-Xian Cao, Dong-ZhuDuan, Qing-Jie Zhao, Yuan-Yong Yang, MengZhoua and Bin He
Green Chem. ASAP DOI:10.1039/C9GC04446A.
正文
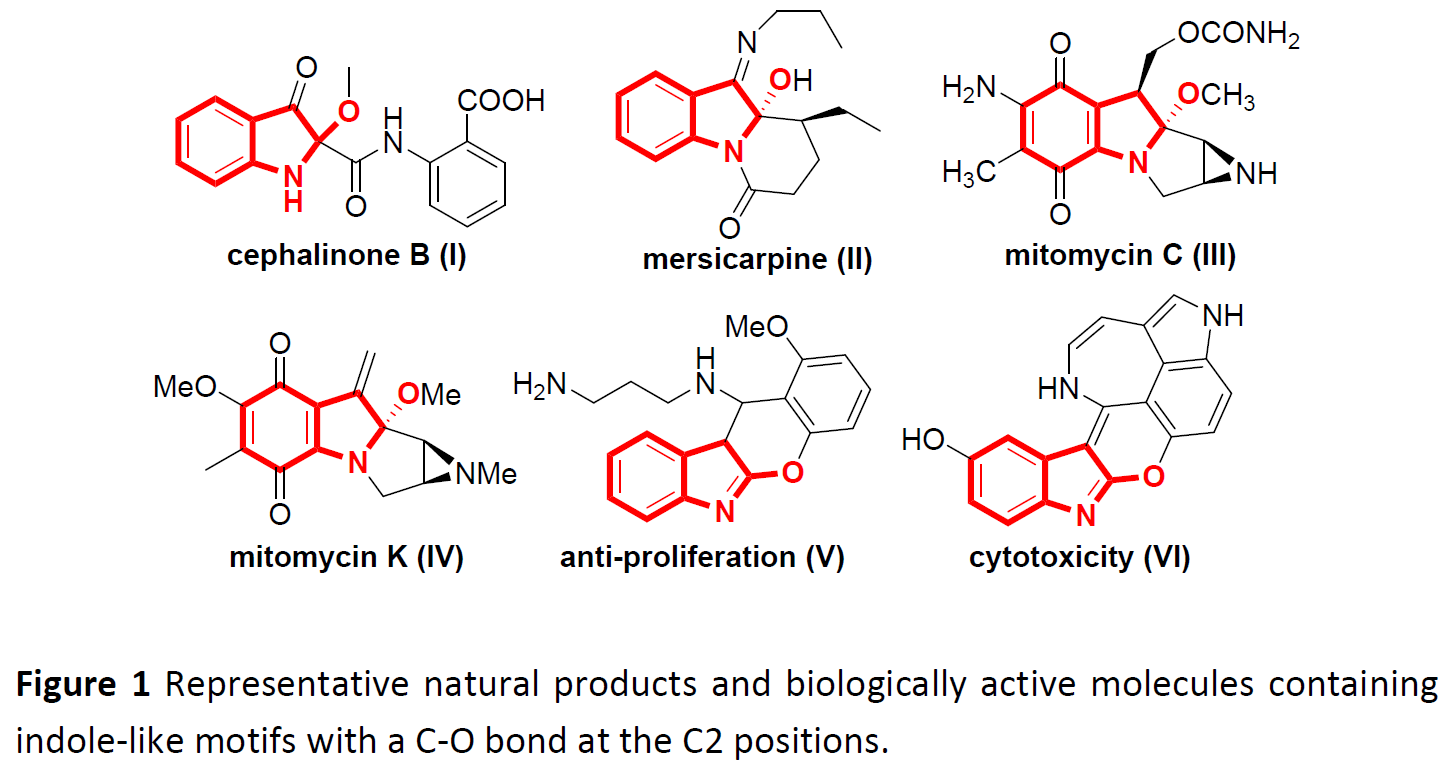
C-O键作为有机化学中最重要的化学键之一。在C2-位上具有C-O键的吲哚骨架广泛存在于天然产物和生物活性分子中(Figure 1)。如,从绿花肖头蕊兰(Cephalanceropsisgracilis)中分离得到的Cephalinone B,从蕊木(Kopisa)物种中分离出的吲哚生物碱-Mersicarpine,同时,丝裂霉素C和K(Mitomycin C and K)作为一种抗肿瘤类抗生素,通过抑制DNA合成发挥作用,用于治疗各种癌症,而吡喃稠合的吲哚衍生物(V和VI)也具有有效的抗增殖活性等。尽管其结构和生物活性的重要性,但在吲哚C2-位构建C-O键的合成策略受到限制。迄今为止,已经开发出在吲哚C2-位构建C-O键的方法如下,吲哚的氧化、2-溴吲哚-3-酮与烯丙基醇的取代反应以及色醇(tryptophols)在恶唑啉/铜催化下的分子内烷氧基自由基加成反应等。然而,化学计量的氧化剂m-CPBA或PhI(OAc)3,Schmidt重排苟刻条件(NaN3/H2SO4),2-溴吲哚-3-酮作为底物或二恶唑啉作为配体是必需的,从而限制了上述策略的合成应用。因此,仍然需要开发一种绿色和经济的方法来构建这类吲哚骨架。
迄今为止,在C-O键的构建已取得重大地进步,特别是羰基化合物的α-酰氧基化反应。然而,由于碳化物氧化为羰基产物,从而导致氧化脱氢交叉偶联形成С-О键更加困难,如酮与羧酸的直接氧化偶联。但是,由于使用了高价碘化合物、重金属盐或非绿色过氧化物作为化学计量的氧化剂,从而导致出现了“氧化剂问题”。2011年,通过使用市售的30%过氧化氢水溶液作为绿色氧化剂,成功地实现了四正丁基碘化铵催化下,氧代羧酸分子内氧化内酯化反应;然而,对于分子间形式,需要更苛刻的反应条件,并且使用TBHP作为化学计量的氧化剂。最近,也有文献报道使用电化学方法,实现酮与羧酸的分子内/间的氧化脱氢偶联反应,但仍需要KBr、NH4OAc等作为化学计量的电解质,并且仍然存在许多不可避免的阳极或阴极性质的过程。因此,尽管在酮与羧酸的直接氧化偶联领域中取得了重大进展,但仍需开发一种绿色且经济的氧化方法。
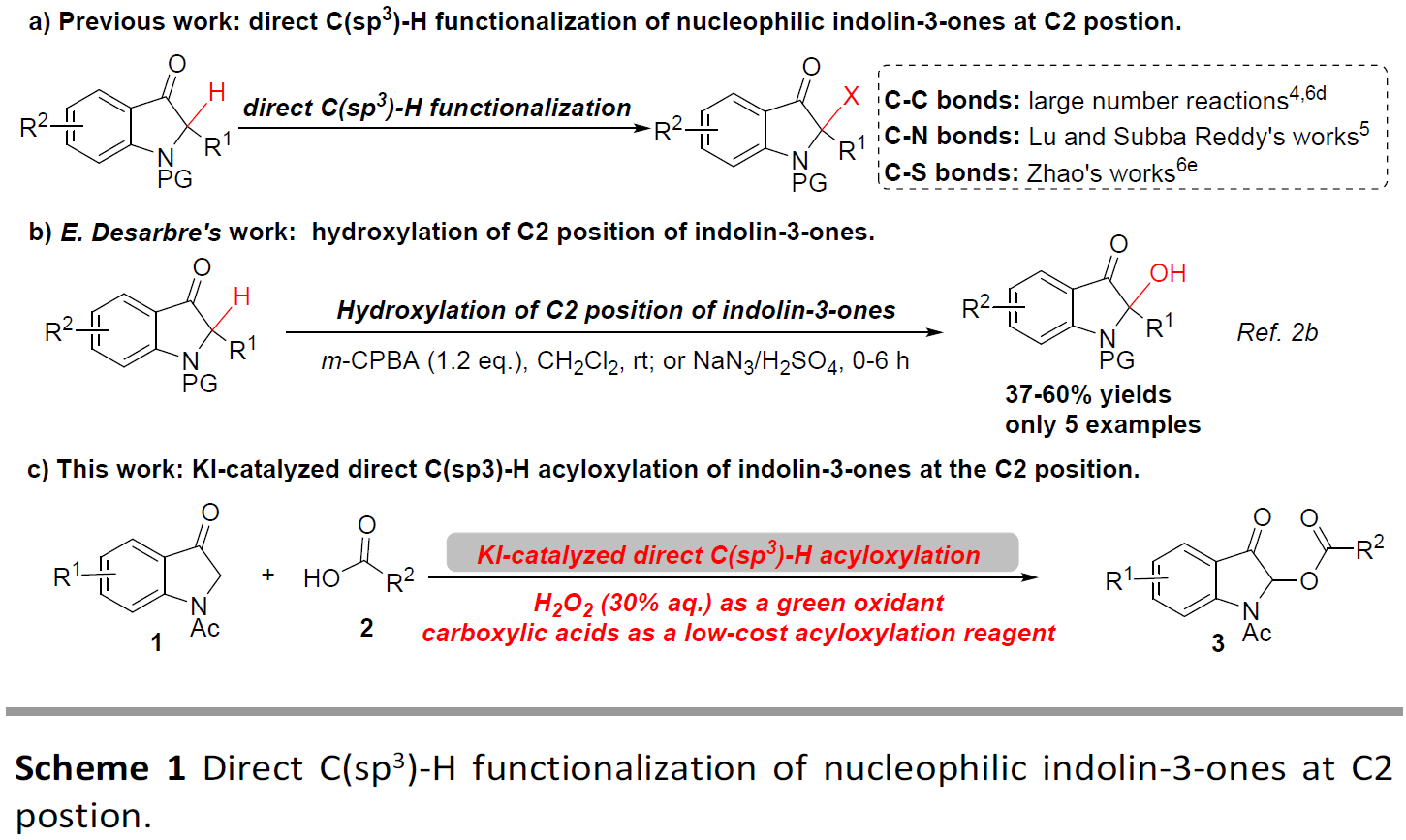
到目前为止,大量的研究主要集中在吲哚-3-酮的C2-位上,直接进行C(sp3)-H官能化反应。然而,大多数情况下涉及C-C键的形成,而C-杂键形成则相对较少(Scheme 1a)。最近,有文献报道可在吲哚-3-酮的C2-位上进行C-N和C-S键的构建。但是,关于C-O键的有效方法却很少被报道。E. Desarbre等人报道了,通过化学计量的氧化剂m-CPBA或复杂的Schmidt重排条件(NaN3/H2SO4),实现吲哚-3-酮的C2-位羟基化反应(Scheme 1b)。随着对吲哚-3-酮和C-H功能化研究的不断关注,贵州医科大学赵永龙课题组在此报道了一种绿色且经济的策略,可通过市售的KI催化剂,30%的过氧化氢水溶液作为绿色氧化剂,实现吲哚-3-酮与羧酸的直接C(sp3)-H酰氧基化反应,从而实现吲哚-3-酮的C2-位上C-O键的构建(Scheme 1c)。
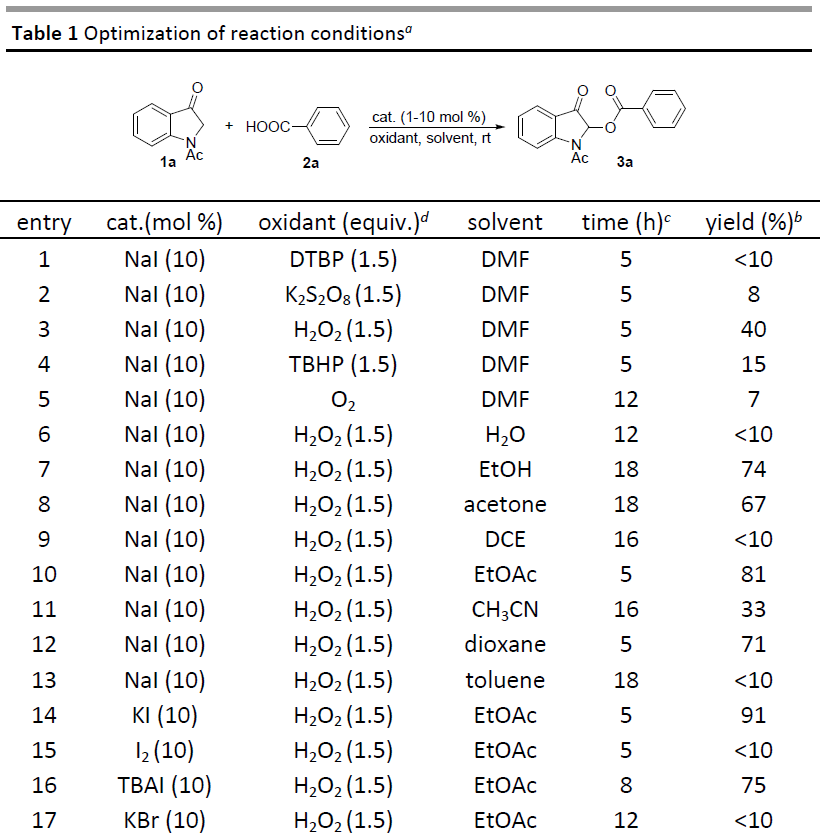
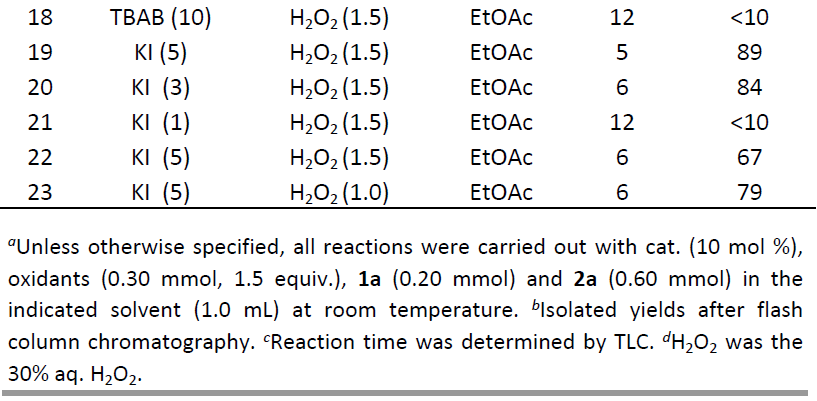
首先,作者以吲哚-3-酮1a和苯甲酸2a作为模型底物,进行了相关酰氧基化反应条件的筛选(Table 1)。当以NaI(10 mol%)作为催化剂,DTBP(1.5当量)作为氧化剂时,可在室温条件下于DMF溶剂中反应5 h,获得痕量的酰氧基化产物3a(entry 1)。为了提高收率,作者筛选了不同的氧化剂(K2S2O8、H2O2、TBHP和O2)(entries2-5),反应结果表明,当以30%H2O2溶液作为氧化剂时,可将3a的收率提高至40%(entry3)。随后,作者也对溶剂进行了筛选(H2O、EtOH、丙酮、DCE、EtOAc、CH3CN、二恶烷和甲苯)(entries6-13),反应结果表明,乙酸乙酯作为最佳溶剂,可获得81%收率的3a(entry10)。紧接着,作者对催化剂的种类进行了筛选(KI、I2、TBAI、KBr和TBAB)(entries 14-18),反应结果表明,KI作为最佳催化剂,可将3a的收率进一步提高至91%(entry14)。此外,当以TBAI作为催化剂时,可在8h的反应时间内获得75%收率的产物3a,但当使用KBr、TBAB或I2作为催化剂时,仅获得痕量的酰氧基化产物3a。最后,作者对催化剂和氧化剂的负载量进行了优化(entries 19-23),当在KI(5 mol%)和H2O2 (1.5 equiv)的EtOAc(1.0 ml)溶剂中室温反应5小时,即可获得所需产物3a(收率89%)(entry19)。
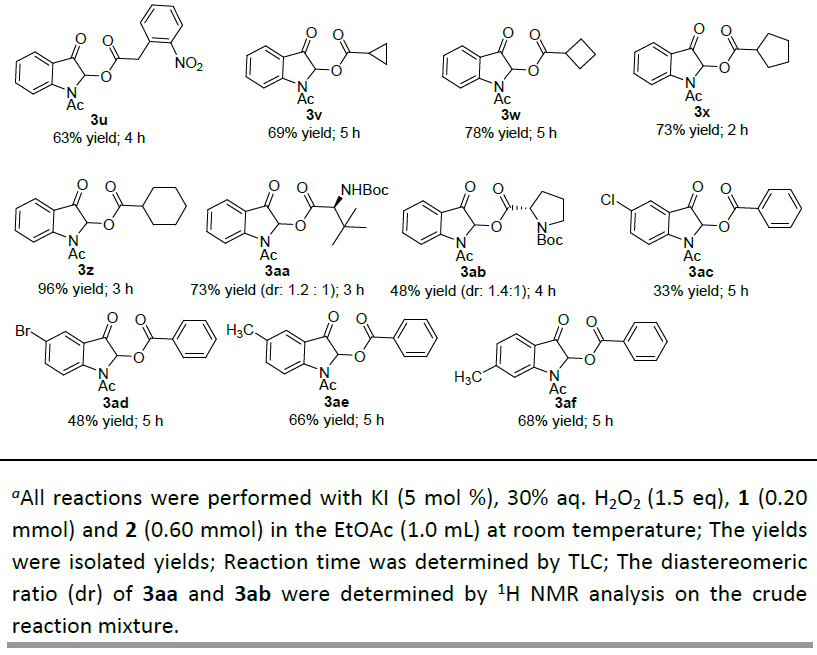
在获得上述最佳反应条件后,作者开始对吲哚-3-酮1与羧酸2的分子间氧化偶联的底物范围进行了研究(Table 2)。该反应具有良好的兼容性,均可获得30-96%产率的酰氧基化产物3a–3z和3aa–3af。首先,作者固定1-乙酰基吲哚-3-酮1a与不同取代羧酸2进行反应,反应结果表明,各种取代的芳基甲酸均为有效的酰氧基化试剂,均以30-94%的收率获得所需的产物3a–3p。应当指出的是,该反应中可以很好地耐受芳基甲酸(如水杨酸、3-糠酸、2-噻吩羧酸、吡咯-2-羧酸等)。此外,作者也成功地将其扩展到其他羧酸(如可聚合丙烯酸(2q)、肉桂酸(2r)、各种环取代的甲酸(2v–2z)、脂族酸(2s–2u)、N-Boc获得氨基酸(2aa,2ab)等),分别获得相应的产物3q–3u和3aa–3ab,收率为48-96%。对于N-Boc氨基酸,尽管非对映选择性差,但仍获得了相应的所需产物3aa和3ab。随后,作者还对吲哚-3-酮的底物进行了扩展,但是仅以33-68%的收率获得所需的产物3ac–3af。此外,酰氧基化产物3k的晶体结构也通过X-射线晶体衍射进一步确定。
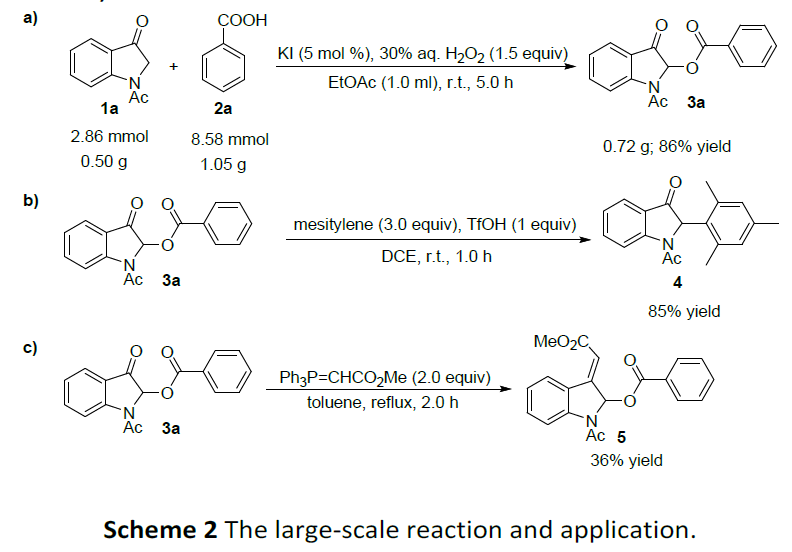
随后,为了进一步证明酰氧基化反应的实用性,作者还进行克级实验及产物的后期修饰(Scheme 2)。首先,作者选择使用吲哚-3-酮1a和苯甲酸2a进行相关的克级反应,在上述标准条件下进行反应,以86%的产率获得相应的酰氧基化产物3a(Scheme 2a)。紧接着,作者对酰氧基化产物3a进行了相关的修饰,如在TfOH存在下与均三甲苯反应,以85%的产率获得2-芳基吲哚-3-酮产物4(Scheme 2b),而通过Witting反应,也可以很容易地转化为产物5,尽管收率为36%(Scheme 2c)。
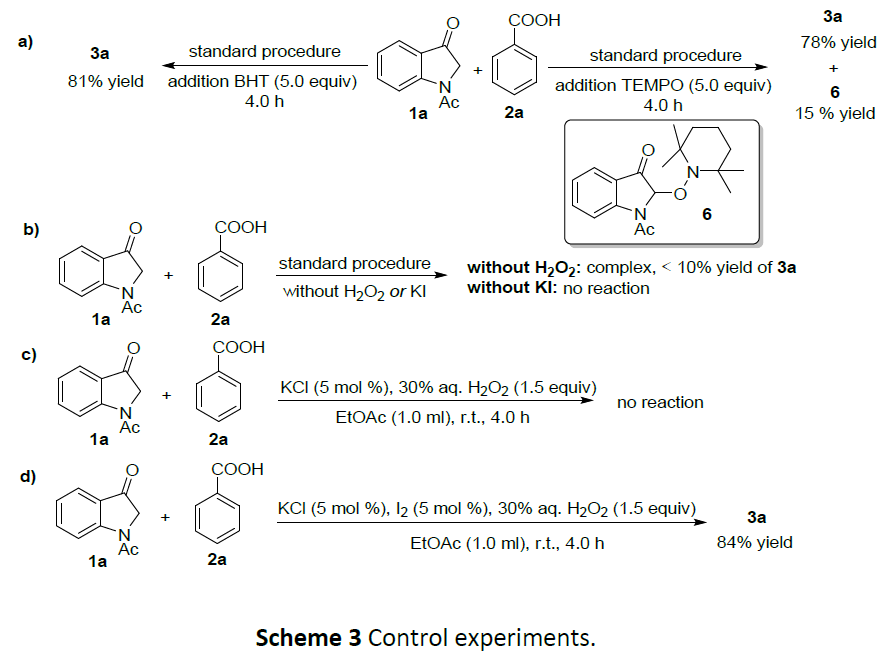
为了进一步了解反应的机理,作者进行了相关的对照实验(Scheme 3)。首先,向该反应体系中加入5当量的TEMPO或BHT作为自由基抑制剂时,酰氧基化产物3a的收率略微降低了约10%(TEMPO:89%→78%, BHT:89%→81%),并以15%的收率形成了吲哚-3-酮1a与TEMPO的加成产物6(Scheme 3a)。该结果表明,该反应可能涉及自由基参与。其次,用I2、TBAB、KCl和KBr代替KI,该酰氧基化反应的反应已被完全抑制(Scheme 3c)。然而,当将KCl(5mol%)和I2(5mol%)添加到标准反应条件中时,获得84%产率的产物3a(Scheme 3d)。此外,在标准条件下,如果没有KI或H2O2水溶液,则无反应发生(Scheme 3b)。这些实验结果表明,K+、Na+或TBA+、I–和氧化剂对于次碘酸盐(M+[IO]–)或碘酸盐(M+[IO2]–)的形成非常重要,可能是由KI、NaI或TBAI和氧化剂(30%的H2O2水溶液)在原位产生的活性碘。
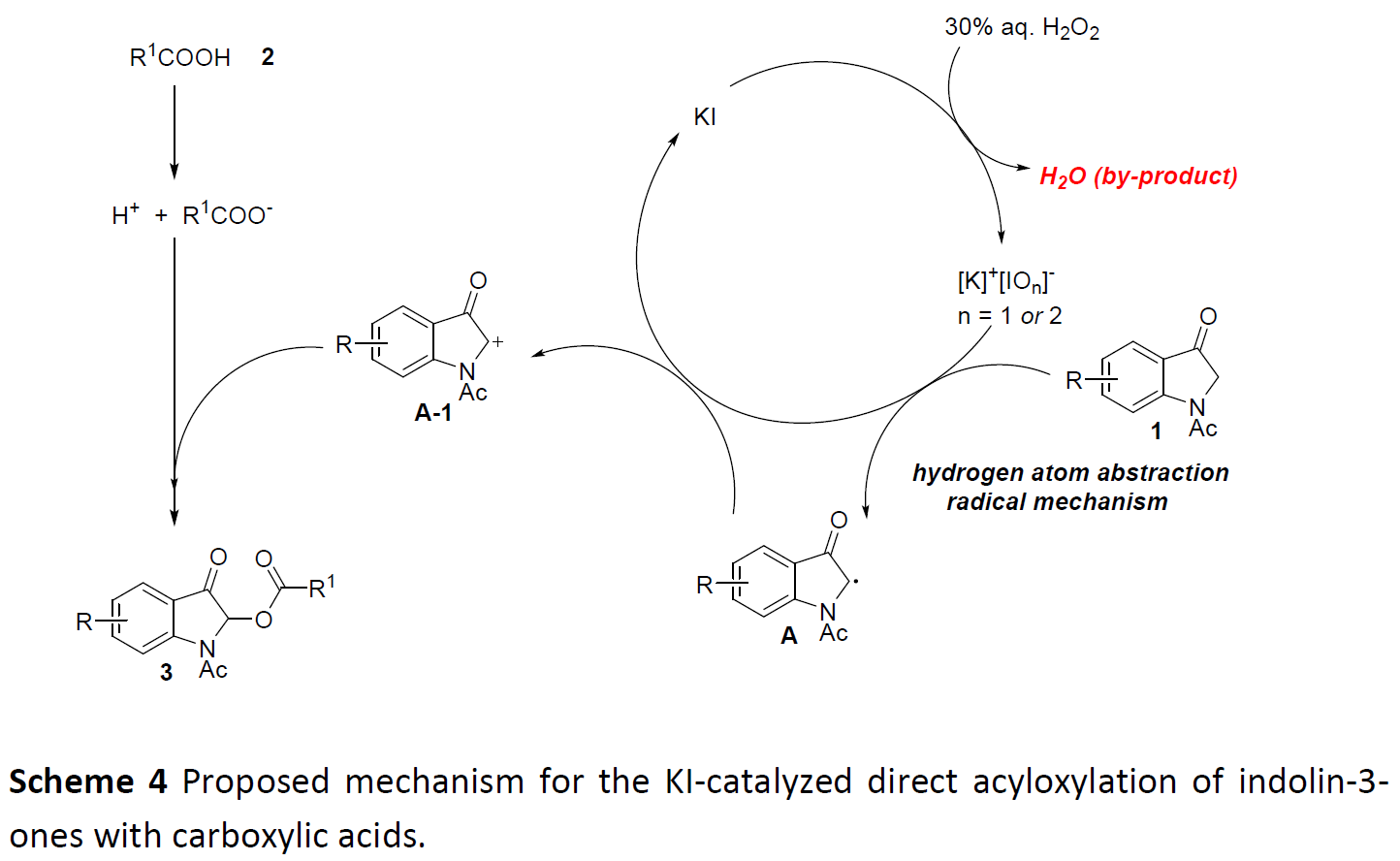
根据上述的实验和相关文献的查阅,作者提出了一种可能的反应机理(Scheme 4)。首先,KI通过H2O2水溶液氧化,形成次碘酸盐([K]+[IO]–)或碘酸盐([K]+[IO2]–)。随后,[K]+[IOn]–(n=1或2)抽取位于C2-位的吲哚-3-酮中的氢原子,获得自由基中间体A,再被[K]+[IOn]–(n=1或2)进一步快速氧化,从而形成相应的碳阳离子中间体A-1。最后,中间体A-1的亲电子碳正离子很容易与羧基阴离子(由各种羧酸产生)反应形成相应的酰氧基化产物3。
总结
贵州医科大学赵永龙课题组,首次报道了使用KI作为催化剂,H2O2作为绿色氧化剂,在室温条件下反应,实现吲哚-3-酮与羧酸的直接酰氧基化反应,获得多种C2-取代的酰氧基吲哚-3-酮衍生物。具有广泛的底物范围(如芳基甲酸、肉桂酸、脂族酸、氨基酸等)、温和的反应条件、较高的收率(高达96%)等优点。此外,合成的产物可作为合成亲核性2-单芳基吲哚-3-酮和3-亚烷基吲哚的通用中间体。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



















No comments yet.