本文作者:石油醚
概要
Marisa C. Kozlowski, 出生于德国汉堡,在纽约州北部的利物浦镇长大。宾夕法尼亚大学化学系教授。JOC副主编,美国癌症协会CDD研究组的主席,Kozlowski教授的研究重点是不对称催化剂的设计和合成方法的研究。 课题组主页:https://www.mckgroup.org/
经历
- 1989年 康奈尔大学的化学学士学位
- 1994年 加州大学伯克利分校获得博士学位(Prof. Paul Bartlett)
- 1995年-1996年 哈佛大学博士后研究员 (Prof. David A. Evans)
- 1997年-至今 宾夕法尼亚大学化学系教授
获奖经历
- DuPont Young Investigator Award in 1998,
- NSF CAREER Award in 2001,
- Alfred P. Sloan Research Fellowship, 2002
- The Kahn Award for Distinguished Teaching by an Assistant Professor at the University of Pennsylvania, an American Cancer Society Beginning ,2002
- Research Scholar Award in 2002,
- ACS Travel Progress Award in 2007,
- The Philadelphia Organic Chemists’ Club Award in 2010,
- The Philadelphia ACS Section Award in 2012,
- Election as an American Chemical Society Fellow in 2013.
研究方向
不对称合成领域中两个挑战是如何快速确定给定工艺的合适催化剂和开发用于大规模工业化应用的经济高效的不对称催化剂。Kozlowski教授的研究重点是开发不对称催化剂的设计和合成方法的研究。
1.不对称的氧化偶联构建C-C键
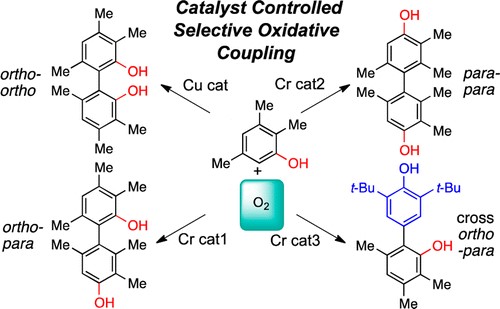
用于氧化C-C键形成的手性催化剂的开发1-4已成为Kozlowski教授实验室的主要重点。除了开发用于多种天然产物的仿生合成方法的巨大潜力外,C-H键可通过廉价的氧化剂氧化并偶联形成C-C键5,这类转化也很吸引人(scheme 1)。在上述情况下偶联中心的不需要额外活化(即作为卤化物,有机金属试剂等),而且反应的副产物主要是水。在以上策略的驱使下,Kozlowski教授开发一种1,5-二氮杂-顺式十氢化萘的铜催化剂(见其他1)3(该类催化剂已证明是2-萘酚衍生物的氧化不对称联芳基偶联反应中有很高的反应性和ee值(scheme 2),使用数据库挖掘鉴定了该催化剂中使用的新型手性二胺6。)氧化联芳基偶联策略已经在天然产物Nigerone及其衍生物7,8,Cercosporin9, Hypocrellin10,11,Perylenequinone 家族天然产物12-14的全合成中得到应用。未来的目标包括在手性联蒽醌和萘二蒽酮天然产物的合成中利用氧化联芳基偶联方法来实现骨架结构的构建。
Scheme 1不对称的氧化偶联
Scheme 2 不对称联芳基偶联反应
2.手性配体和催化剂的计算机辅助设计
非对映和对映选择性是有机化学反应有效合成复杂手性靶标的重要组成部分之一,对于开发手性配体和催化剂有很重要的意义。Kozlowski教授实验室已经开发了多种计算工具来协助研究人员设计和优化手性催化剂(包括数据库搜索用于识别不对称反应的手性配体类型的搜索方法15,功能映射作为识别非对称反应立体控制的方法16,配体家族计算筛选发现17)。除上述方法之外,Kozlowski教授实验室18已经开发了半经验的量子力学定量结构选择性关系(Quantitative structure selectivity relationship,简称QSSR),用于准确地预测手性催化剂的对映体过量。 在一个实例中,Kozlowski教授将应用QSSR模型描述β-氨基醇催化的Et2Zn不对称加成到PhCHO中,为其对映关系提供了一种可靠的预测。并将各种β-氨基醇催化剂的结构与其对映选择性相关联。Kozlowski教授的方法方便快捷计算了新催化剂的选择性。随后对新催化剂的化学合成和分析表明,该模型非常有用,并且易于区分低,中和高选择性的催化剂。(Scheme 3)
Scheme 3 QSSR应用于二乙基锌与苯甲醛加成反应催化剂模型的分析
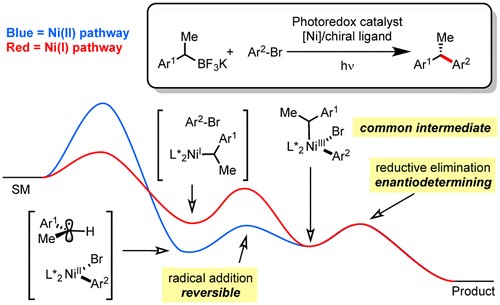
Kozlowski教授除了上面研究以外,还使用密度泛函理论来研究镍催化的光氧化还原自由基的交叉偶联这一重要转变的机理细节19。计算揭示了涉及烷基镍(I)配合物的新反应途径,该配合物是通过向Ni(0)中添加烷基而产生并且可能与先前提出的机理同时起作用。 分析该转化的对映体选择性过渡态,发现了涉及Ni(III)中间体的动态动力学拆分(DKR)的立体诱导的过渡态,其中立体选择的决定步骤在还原消除阶段产生。(Figure 1)Kozlowski教授还应用计算机辅助对于选择性炔丙基化和烯丙基化的计算研究20,Pd催化的不对称的 Suzuki-Miyaura and Negishi Cross-Coupling 反应配体效应的研究21等多个方面的研究。
Figure 1密度泛函理论来研究镍与光协同催化的反应机理
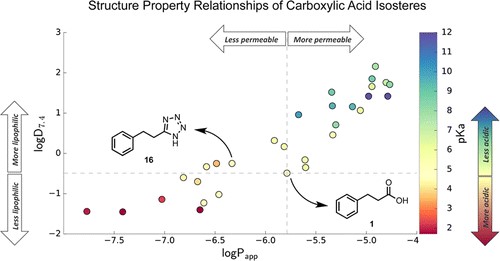
药物化学中用替代结构或(生物)-等位酮替代羧酸的经典策略。基于的上述原理是,通过替代结构维持对于生物活性至关重要的羧酸特征,可以适当地改变其理化性质,可以得到改进的类似物。在这种情况下,希望能够对羧酸等替代物的物理化学性质进行系统的评估,以便可能的替代品的更聪明的决定被用于模拟设计中。Kozlowski教授22报告了35种苯基丙酸衍生物的结构-性质关系(SPR),其中羧酸部分被一系列已知的等排物取代。生成的数据集提供了对这些替代物与羧酸类似物相比对物理化学性质的相对影响的评估。(Figure 2 )
Figure 2羧酸等位基因的结构性质关系
3. HTE 实验
通过高通量实验实验室进行反应开发和优化(目前还在研究中)
其他
1.Kozlowski教授开发的1,5-二氮杂-顺式十氢化萘的铜催化剂
2.手性配体的计算机辅助设计
剑桥晶体结构数据库)(CSD)(http://webcsd.ccdc.cam.ac.uk/)
化学文摘服务三维数据库(CAS-3D)的部分以及TRIAD三环结构数据库
3. 由Marisa C. Kozlowski教授和Patrick J. Walsh教授编写的“Fundamentals of Asymmetric catalysis”一书在2018年由丁奎岭院士主持翻译为“不对称催化基础”成为我们对于不对称化学领域的重要研究课本之一。
参考文献
- [1] Kang, H. et al. Asymmetric Oxidative Coupling of Phenols and Hydroxycarbazoles. Org.Lett. (2017) 19, 5505-5508, doi:10.1021/acs.orglett.7b02552.
- [2] DiMauro, E. F. & Kozlowski, M. C. The First Catalytic Asymmetric Addition of Dialkylzincs to α-Ketoesters. Org.Lett. (2002) 4, 3781-3784, doi:10.1021/ol026315w.
- [3] Kozlowski, M. C., Li, X., Carroll, P. J. & Xu, Z. Copper(II) Complexes of Novel 1,5-Diaza-cis-decalin Diamine Ligands: An Investigation of Structure and Reactivity. Organometallics (2002) 21, 4513-4522, doi:10.1021/om020425p.
- [4] DiMauro, E. F. & Kozlowski, M. C. BINOL−Salen Metal Catalysts Incorporating a Bifunctional Design. Org.Lett. (2001) 3, 1641-1644, doi:10.1021/ol0158213.
- [5] Allen, S. E., Walvoord, R. R., Padilla-Salinas, R. & Kozlowski, M. C. Aerobic Copper-Catalyzed Organic Reactions. Chem. Rev. (2013) 113, 6234-6458, doi:10.1021/cr300527g.
- [6] Li, X., Yang, J. & Kozlowski, M. C. Enantioselective Oxidative Biaryl Coupling Reactions Catalyzed by 1,5-Diazadecalin Metal Complexes. Org.Lett. (2001) 3, 1137-1140, doi:10.1021/ol015595x.
- [7] DiVirgilio, E. S., Dugan, E. C., Mulrooney, C. A. & Kozlowski, M. C. Asymmetric Total Synthesis of Nigerone. Org.Lett. (2007) 9, 385-388, doi:10.1021/ol062468y.
- [8] Kozlowski, M. C., Dugan, E. C., DiVirgilio, E. S., Maksimenka, K. & Bringmann, G. Asymmetric Total Synthesis of Nigerone and ent-Nigerone: Enantioselective Oxidative Biaryl Coupling of Highly Hindered Naphthols. Adv. Synth. Catal.,(2007) 349, 583-594, doi:10.1002/adsc.200600570.
- [9] Morgan, B. J., Dey, S., Johnson, S. W. & Kozlowski, M. C. Design, Synthesis, and Investigation of Protein Kinase C Inhibitors: Total Syntheses of (+)-Calphostin D, (+)-Phleichrome, Cercosporin, and New Photoactive Perylenequinones. J. Am. Chem. Soc. (2009) 131, 9413-9425, doi:10.1021/ja902324j.
- [10] O’Brien, E. M., Morgan, B. J. & Kozlowski, M. C. Dynamic Stereochemistry Transfer in a Transannular Aldol Reaction: Total Synthesis of Hypocrellin A. Angew. Chem. Int. Ed. (2008) 47, 6877-6880, doi:10.1002/anie.200800734.
- [11] O’Brien, E. M., Morgan, B. J., Mulrooney, C. A., Carroll, P. J. & Kozlowski, M. C. Perylenequinone Natural Products: Total Synthesis of Hypocrellin A. J. Org. Chem. (2010) 75, 57-68, doi:10.1021/jo901386d.
- [12] Mulrooney, C. A., Morgan, B. J., Li, X. & Kozlowski, M. C. Perylenequinone Natural Products: Enantioselective Synthesis of the Oxidized Pentacyclic Core. J. Org. Chem. (2010) 75, 16-29, doi:10.1021/jo9013832.
- [13] Morgan, B. J., Mulrooney, C. A., O’Brien, E. M. & Kozlowski, M. C. Perylenequinone Natural Products: Total Syntheses of the Diastereomers (+)-Phleichrome and (+)-Calphostin D by Assembly of Centrochiral and Axial Chiral Fragments. J. Org. Chem. (2010) 75, 30-43, doi:10.1021/jo901384h.
- [14] Kozlowski, M. C., Morgan, B. J. & Linton, E. C. Total synthesis of chiral biaryl natural products by asymmetric biaryl coupling. Chem. Soc. Rev. (2009) 38, 3193-3207, doi:10.1039/B821092F.
- [15] Kozlowski, M. C. & Panda, M. Computer-aided design of chiral ligands: Part I. Database search methods to identify chiral ligand types for asymmetric reactions. J. Mol. Graphics Modell. (2002) 20, 399-409, doi:10.1016/S1093-3263(01)00138-3.
- [16] Kozlowski, M. C. & Panda, M. Computer-Aided Design of Chiral Ligands. Part 2. Functionality Mapping as a Method To Identify Stereocontrol Elements for Asymmetric Reactions. J. Org. Chem. (2003) 68, 2061-2076, doi:10.1021/jo020401s.
- [17] Kozlowski, M. C., Waters, S. P., Skudlarek, J. W. & Evans, C. A. Computer-Aided Design of Chiral Ligands. Part III. A Novel Ligand for Asymmetric Allylation Designed Using Computational Techniques. Org.Lett. (2002) 4, 4391-4393, doi:10.1021/ol026971w.
- [18] Kozlowski, M. C., Dixon, S. L., Panda, M. & Lauri, G. Quantum Mechanical Models Correlating Structure with Selectivity: Predicting the Enantioselectivity of β-Amino Alcohol Catalysts in Aldehyde Alkylation. J. Am. Chem. Soc. (2003) 125, 6614-6615, doi:10.1021/ja0293195.
- [19] Gutierrez, O., Tellis, J. C., Primer, D. N., Molander, G. A. & Kozlowski, M. C. Nickel-Catalyzed Cross-Coupling of Photoredox-Generated Radicals: Uncovering a General Manifold for Stereoconvergence in Nickel-Catalyzed Cross-Couplings. J. Am. Chem. Soc. (2015) 137, 4896-4899, doi:10.1021/ja513079r.
- [20] Zou, Y. et al. A Computational Investigation of the Ligand-Controlled Cu-Catalyzed Site-Selective Propargylation and Allenylation of Carbonyl Compounds. Org.Lett. (2017) 19, 6064-6067, doi:10.1021/acs.orglett.7b02845.
- [21] Patel, N. D. et al. Computationally Assisted Mechanistic Investigation and Development of Pd-Catalyzed Asymmetric Suzuki–Miyaura and Negishi Cross-Coupling Reactions for Tetra-ortho-Substituted Biaryl Synthesis. ACS Catal. (2018) 8, 10190-10209, doi:10.1021/acscatal.8b02509.
- [22] Lassalas, P. et al. Structure Property Relationships of Carboxylic Acid Isosteres. J. Med. Chem. (2016) 59, 3183-3203, doi:10.1021/acs.jmedchem.5b01963.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!






























No comments yet.