引言
癌症,又名恶性肿瘤,来源于细胞的不正常增生,且这些增生的细胞可能侵犯身体的其他部分,是一种因控制细胞分裂增殖机制失常而引起的疾病。根据世卫组织最新的数据表明,癌症是全球第二大死因,仅在2015年就造成全球880万人死亡,其中最为常见的癌症是:肺癌、肝癌、结肠直肠癌、胃癌和乳腺癌[1]等。因此,准确诊断癌症并进行针对性治疗至关重要,目前临床治疗手段主要包括外科手术、放疗、化疗等。所谓化疗,指的是用化学药物来杀死癌细胞从而达到治疗癌症的目的,例如紫杉醇就是一种天然的化疗药物。此外,人工合成的化疗药物,例如吉西他滨,目前也在癌症治疗中发挥不可替代的作用。
现代化疗之父西德尼·法伯和化疗药物吉西他滨
正文
吉西他滨的发现
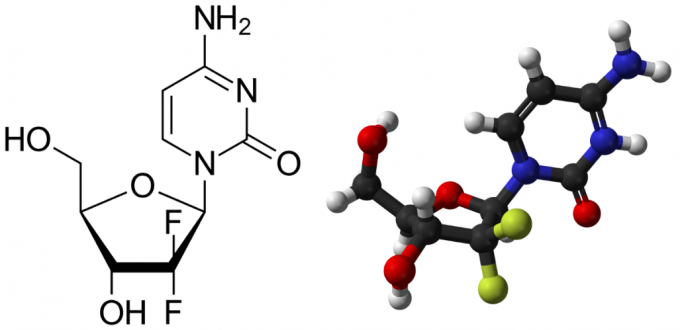
20世纪80年代,美国著名跨国制药公司礼来合成了吉西他滨并将其用作抗病毒药物,然而体外实验过程中却发现它可以杀死白血病细胞,随后人们对其抗癌活性进行了广泛研究并由此发现它极佳的杀死胰腺癌细胞能力。1996年,吉西他滨在美国上市,并获得FDA 批准用于胰腺癌的治疗,随后1998年又获批用于非小细胞肺癌的治疗。凭借抗癌谱广、作用机制独特、毒性反应低、与其他化疗药物无交叉耐药且毒性反应无叠加等特点,目前,吉西他滨已在全球超过90个国家获批使用,成为治疗非小细胞肺癌的一线药物和治疗胰腺癌的“金标准”。[2]
吉西他滨的化学结构及球棍模型
吉西他滨的作用机制
癌细胞的增殖比正常细胞快并且不受控制,因此抗癌药物的作用原理通常是阻断细胞分裂进而抑制癌细胞生长。正常细胞从有丝分裂结束后生长,再到下一次分裂结束的循环过程被称作细胞周期(cell cycle)。它通常可划分为分裂间期(I期)和分裂期(M期),其中前者又可进一步细分为DNA合成前期(G1),DNA合成期(S)和DNA合成后期(G2),在此期间的任务主要是完成染色质中的DNA复制和相关蛋白质的合成。
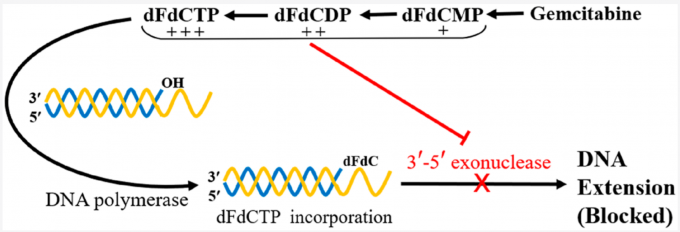
吉西他滨进入人体后由脱氧胞嘧啶激酶活化起作用,形成吉西他滨磷酸盐(dFdCMP)、吉西他滨二磷酸盐(dFdCDP)和吉西他滨三磷酸盐(dFdCTP),其中后两者为活性物质,可以抑制DNA合成:dFdCDP通过抑制核糖核酸还原酶,使三磷酸脱氧核苷产生量减少(合成DNA所必需),尤其是脱氧三磷酸胞苷(dCTP)减少,最终导致细胞凋亡;dFdCTP与dCTP竞争掺入DNA链中使DNA链延长,但DNA聚合酶不能去除掺入的dFdCTP,进而使延伸的DNA链不能修复,从而抑制DNA合成,最终导致细胞凋亡。[3]
吉西他滨的作用机制示意图[3]
吉西他滨的合成
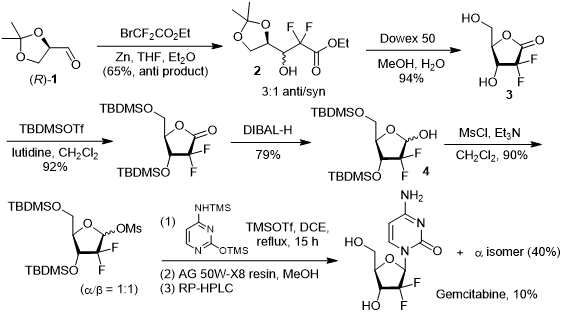
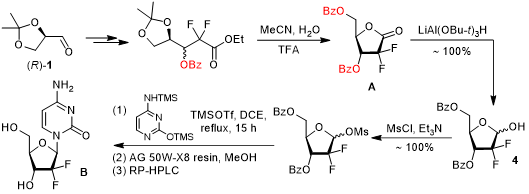
礼来公司以商品名“健择(Gemzar)”将吉西他滨推入市场,最初的合成路线也是由礼来公司在1988年开发。Hertel等人以缩酮保护的D-甘露醛1为起始原料,经Reformatsky反应同时引入氟原子和酯基官能团,最终得到顺反异构体混合物,经手性HPLC分离得到反式产物2。随后,利用离子交换树脂Dowex 50脱去缩酮保护基的同时发生分子内羟醛缩合生成中间产物3,游离的羟基首先通过形成硅醚进行保护,然后利用强还原剂二异丁基氢化铝(DIBAL-H)对羰基进行还原得到关键中间体4。为了利用亲核取代反应引入碱基部分,研究人员则将产物4中的羟基转变成甲磺酸酯以增强其离去能力,完成取代反应后再利用反相HPLC对异构体进行分离即可获得纯净的ꞵ-差向异构体。[4]
吉西他滨的早期合成路线
显然,礼来公司最初的合成路线并不具备立体选择性,必须依赖HPLC等手段对异构体进行拆分,也无法实现大规模生产。1991年,礼来公司的研究人员Chou等人对上述路线进行了改进,只需要通过结晶法就可以对异构体进行分离。他们的合成路线并未有大幅改变,只是调整了中间体A的保护基即可通过结晶法获得单一构型的中间产物。幸运的是,最终产物B也可通过结晶法进行分离,操作简单,无需借助仪器。[5]
吉西他滨的改进合成路线
结束语
吉西他滨作为治疗非小细胞肺癌最有效的一线药物之一,也是目前治疗晚期胰腺癌的“金标准”。它具有高缓解率,延长生存期和低副反应等优点,特别是其可有效延长病人的生命,提高病人生存质量。多种肿瘤的临床研究证明,即使在吉西他滨缓解率不高的研究中,其生存质量还是得到明显改善。而且,吉西他滨给药方便,适合门诊使用,更符合药物经济学原则。因此,吉西他滨的众多特性在肿瘤治疗更加重视人性化的今天得到了完美的体现。























No comments yet.