本文作者:杉杉
导读
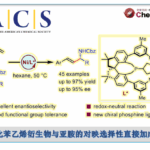
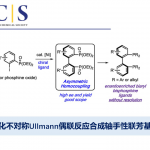
醇类化合物作为有机合成中常见的原料,可作为构建C-C键的有效底物。近日,北京生命科学研究所李超课题组在JACS上发表论文,报道了将阳极烷氧基三苯基膦离子(alkoxytriphenylphosphonium ion)合成与镍催化阴极还原性交叉偶联相结合,从而实现C(sp2)-C(sp3)键的构建,其中易得的游离醇和芳基溴化物均为合适的底物。同时,该反应具有广泛的底物范围、良好的官能团耐受性等特点。此外,通过对复杂的天然产物和药物的后期芳基化,进一步证明了反应中的实用性。
Electrochemically Enabled, Nickel-Catalyzed Dehydroxylative Cross-Coupling of Alcohols with Aryl Halides
Zijian Li, Wenxuan Sun, Xianxu Wang, Luyang Li, Yong Zhang, and Chao Li*
J.Am. Chem. Soc.2021, 143, 3536-3543. DOI:10.1021/jacs.0c13093
正文
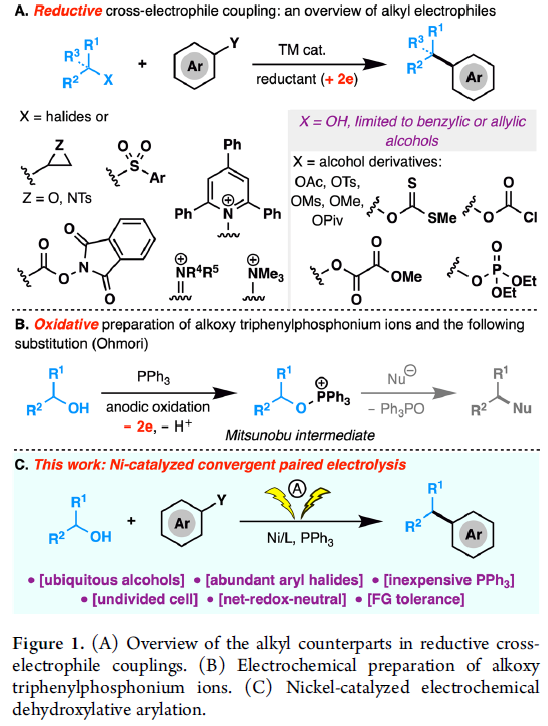
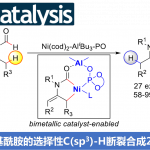
开发一种高效且实用的方法以构建sp2-和sp3-杂化碳之间的偶联一直作为合成化学中的核心课题。近年来,过渡金属催化两个亲电子试剂的还原性交叉偶联已成为形成C(sp2)-C(sp3)键的有效策略,可避免有机金属试剂的制备和使用,从而简化了反应过程并提高了官能团的相容性。虽然该领域的开创性研究集中在使用卤代烷作为C(sp3)偶联底物,但此后范围扩大到了环氧化物、烷基羧酸衍生物、烷基胺衍生物、烷基砜等(Figure 1A, left)。同时,醇类化合物也可作为潜在的C(sp3)偶联底物。但是,由于C-O键具有较高的键解离能和OH-基团的低离去能力,因此很少将醇直接用作交叉偶联剂中的烷基化剂,除π-活化的烯丙基和苄醇以外。尽管在还原型交叉偶联反应中对许多醇衍生物进行了广泛地研究,包括乙酸烷基酯、甲苯磺酸酯、黄原酸酯、新戊酸酯、草酸酯、磷酸酯、甲基醚、氯甲酸酯等(Figure 1A, right),但此类衍生物需要从其醇前体制备,并且底物范围通常限于烯丙基和苄基醇衍生物。因此,仍需开发一种可直接通过游离醇以构建C(sp2)-C(sp3)键的通用方法。
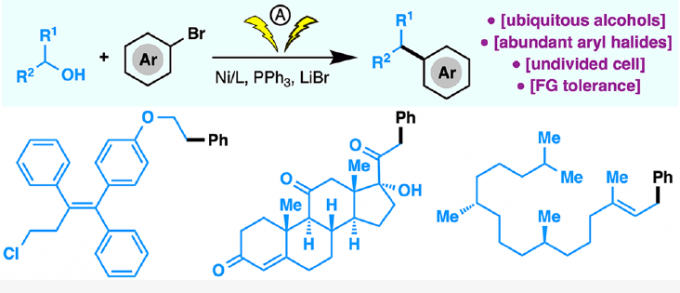
近年来,电化学合成在有机反应中是一种的高效方法。1980年,Ohmori课题组[1]报道了,三苯膦(PPh3)与醇进行阳极氧化,生成烷氧基三苯基膦离子(Mitsunobu反应的关键中间体)(Figure 1B),这些烷氧基衍生物还可以用作烷基化剂以形成C-X键(X = O,N,S,Br,F等),而Ph3PO则作为离去基团。在此,北京生命科学研究所李超课题组将电化学氧化和还原性交叉偶联相结合,从而实现游离醇和芳基溴化物的直接的脱羟基交叉偶联反应,高效地构建了C(sp2)-C(sp3)键(Figure 1C)。
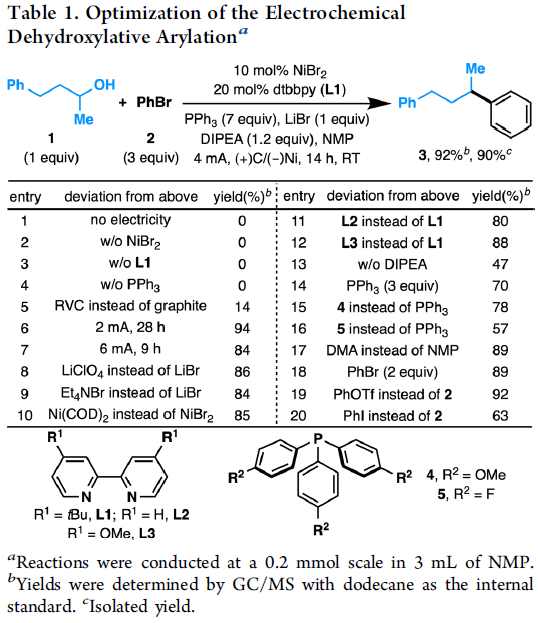
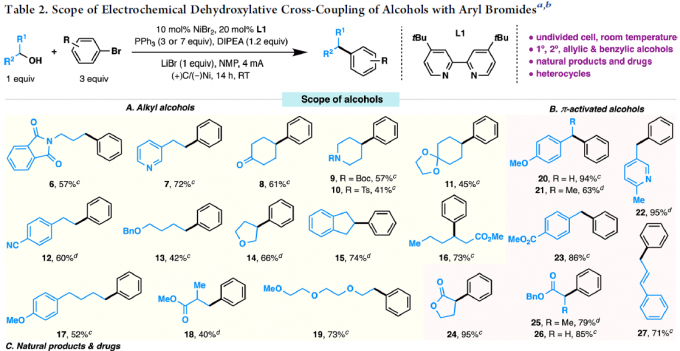
作者以4-苯基-2-丁醇(1)和溴苯(2)作为模型底物,对反应条件进行了大量的筛选。反应的最佳条件为:以NiBr2为催化剂,L1为配体,DIPEA为碱,NMP为溶剂,LiBr为电解质,可在无隔膜电解槽中(4 mA)室温反应,获得90%收率的偶联产物3。
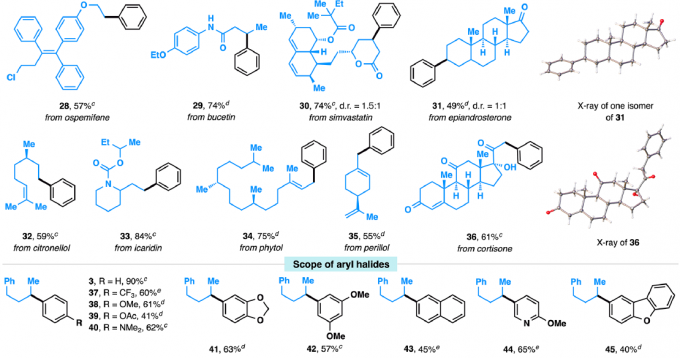
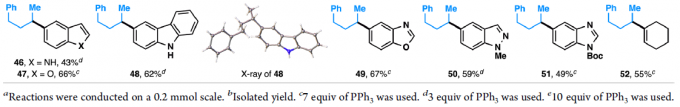
紧接着,作者对反应的底物范围进行了扩展(Table 2)。一系列不同官能团的烷基伯(仲)醇和π-活化的醇,均可顺利反应,获得相应的产物6–27。值得注意的是,一系列复杂的药物(如奥培米芬(ospemifene,28)、西汀(bucetin,29)、辛伐他汀(simvastatin,30)和埃卡瑞丁(icaridin,33))和天然的醇(如表雄酮(epiandrosterone,31)、香茅醇(citronellol,32)、叶绿醇(phytol,34)、紫苏醇(perillol,35)和可的松(cortisone,36))也是有效的底物,进一步证明了反应的实用性。此外,芳环上具有不同取代的芳基溴化物或含有萘基、杂环取代基、溴化乙烯的底物,均可顺利反应,获得相应的产物37–52。
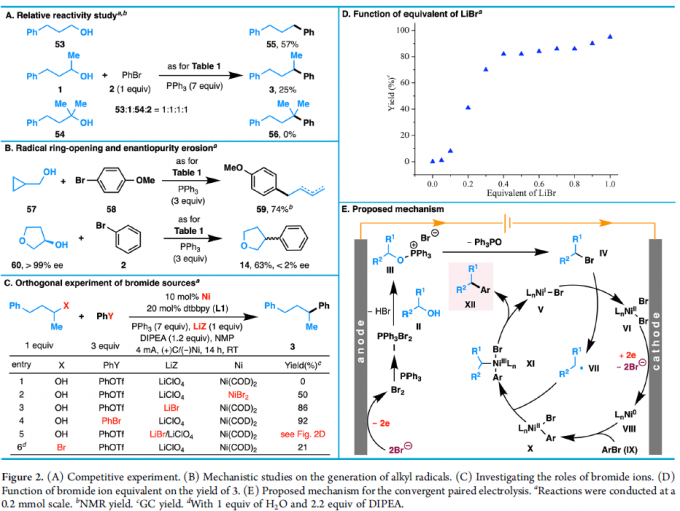
同时,通过自由基开环实验和对映体纯度损失现象(Figure 2B),反应可能通过脱羟基芳基化过程生成烷基自由基。由于C-OH键不易直接被均裂,似乎有两个潜在的烷基自由基生成途径:(i)烷氧基三苯基膦离子可通过低价镍催化剂直接还原,或通过单电子转移(SET)在阴极还原,可能产生Ph3PO和烷基自由基。(ii)烷氧基三苯基膦离子可进一步与源自电解质LiBr或催化剂NiBr2的溴离子反应形成烷基溴,可经单电子还原生产烷基自由基。此外,不同的溴源对于反应至关重要。
根据上述的实验和相关文献的查阅[2],作者提出了一种可能的反应机理(Figure 2E)。首先,醇通过阳极Appel反应生成烷基溴(IV),经单电子转移进行还原,从而生成Ni(II)配合物VI和烷基自由基VII。紧接着,Ni(II)配合物VI从阴极吸收两个电子,生成Ni(0)配合物VIII(可以扩散到反应溶液中)。值得注意的是,该还原过程还会释放出两个溴离子,可在阳极氧化中重复使用,从而实现Appel催化反应。随后,VIII与芳基溴化物IX经氧化加成形成Ni(II)芳基配合物X,再与烷基自由基VII进行加成形成Ni(III)配合物XI。最后,经还原消除即可获得偶联产物XII和Ni(I)配合物V,从而实现催化循环。
总结
北京生命科学研究所李超课题组报道了在一个无隔膜电解槽将阳极Appel反应和镍催化阴极亲电反应相结合,从而实现易得游离醇和芳基溴化物的直接芳基化反应,具有广泛的底物范围、良好的官能团耐受性等特点。同时,该反应避免在Appel反应中使用化学计量的危险CBr4或Br2,避免分离有毒的烷基卤化物等。此外,通过对复杂天然产物和药物的后期修饰,进一步证明了反应的实用性。




















No comments yet.