本文作者:Summer
导读
香港科技大学孙建伟教授团队成功发展了四氢-β-咔唑类化合物的不对称氧化重排反应。采用NIS作为氧化剂,手性磷酸作为催化剂,能够以良好至优秀的收率与对映选择性获得一系列螺氧化吲哚化合物。相关研究成果发表于
Catalytic Enantioselective Synthesis of Spirooxindoles by Oxidative Rearrangement of Indoles
C. Qian, P. Li, J.i Sun, Angew. Chem. Int. Ed. 2021, 60, 5871. DOI: 10.1002/anie.202015175.
正文
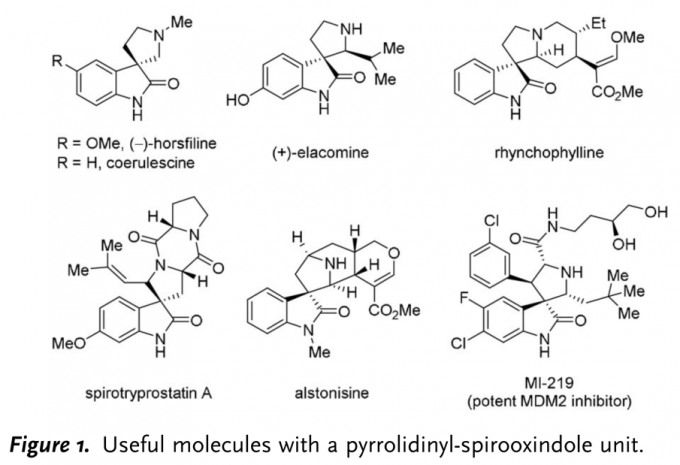
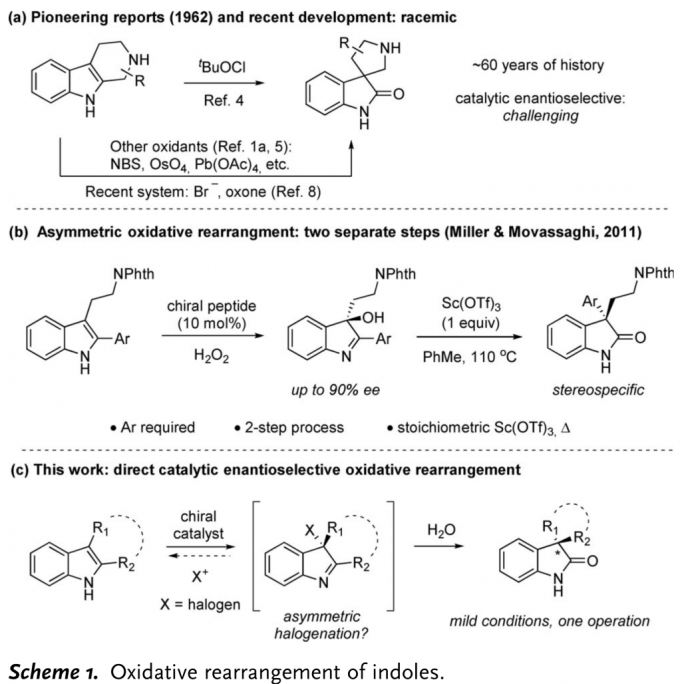
螺氧化吲哚广泛存在于天然产物以及生物活性分子中,因此,该类化合物的不对称合成受到化学家们的广泛关注(Figure 1)。四氢-β-咔啉类化合物的氧化重排已成为构建螺氧化吲哚骨架中最受欢迎的方法,然而,四氢-β-咔啉的对映选择性氧化重排方法学的研究却面临巨大挑战(Scheme 1a)。[1]2011年,Miller与Movassaghi团队首次报道了肽催化的吲哚不对称氧化反应,生成手性3-羟基吲哚亚胺,接下来,在Sc(OTf)3催化下,发生立体专一性重排反应。[2] 然而,上述的两步过程由于实验操作不兼容,因而无法实现一锅与催化量的反应,并且第二步反应条件较为苛刻,同时底物范围较为有限(Scheme 1b)。基于上述背景研究,香港科技大学孙建伟成功开发出手性磷酸催化的四氢-β-咔啉类化合物的不对称氧化重排反应方法学,能够以良好至优秀的收率与对映选择性获得一系列螺氧化吲哚类化合物。
(图片来源:Angew. Chem. Int. Ed.)
(图片来源:Angew. Chem. Int. Ed.)
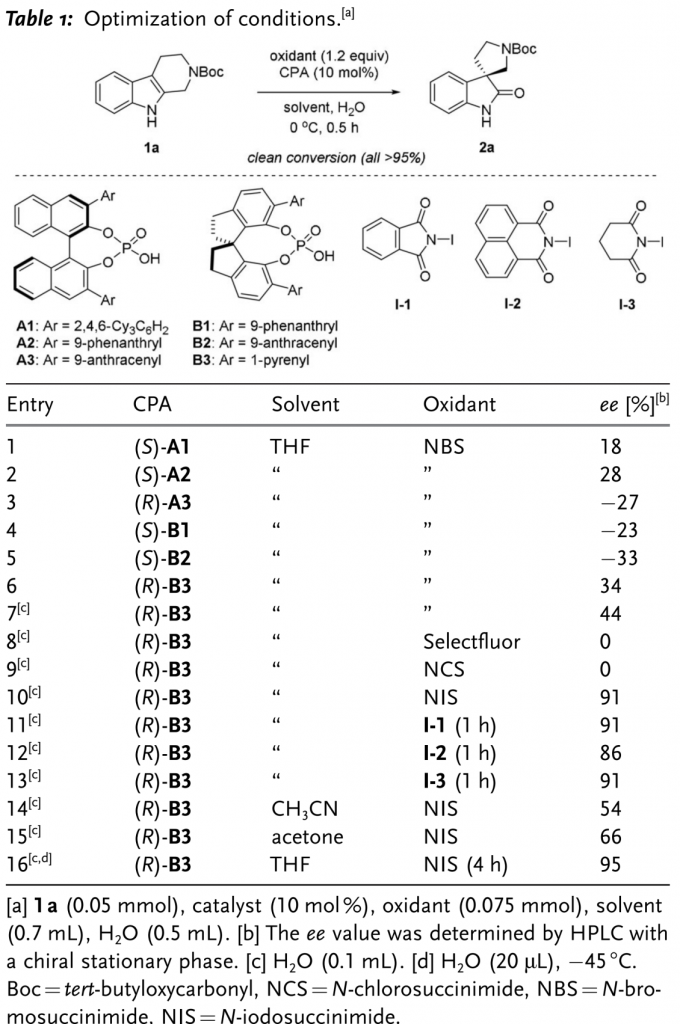
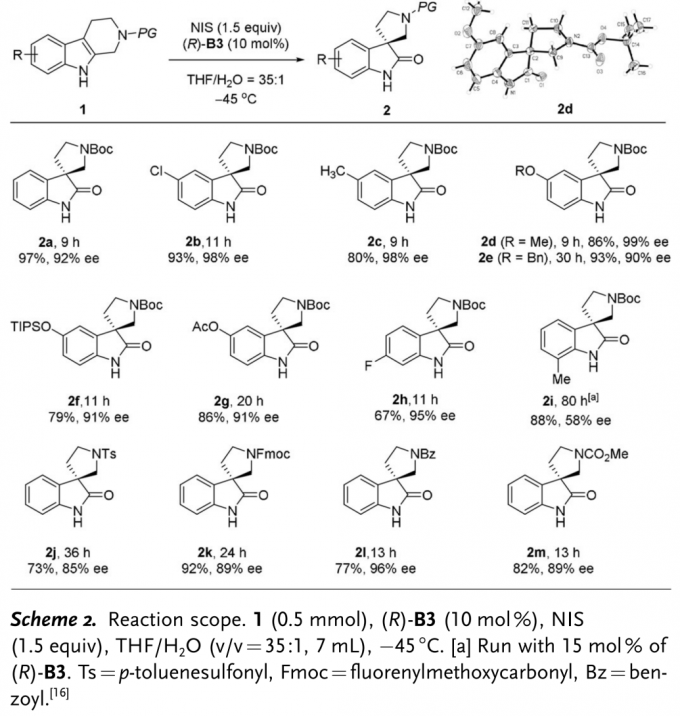
首先,作者以N-Boc保护的四氢-β-咔啉1a作为模板底物,通过对催化剂、氧化剂以及溶剂等条件进行筛选,确定最佳的反应条件为(Table 1):采用10 mol%(R)-B3作为催化剂,1.5eq. NIS作为氧化剂,THF/H2O (v/v=35:1)作为溶剂,在-45 ℃条件下,反应9 h,能够以97%的收率、92%的对映选择性获得相应手性产物2a。
(图片来源:Angew. Chem. Int. Ed.)
在上述最佳反应条件下,作者对上述反应的底物范围进行了考察(Scheme 2)。研究表明,上述反应条件对于各种芳基取代的四氢-β-咔啉以及 N-Ts、N-Fmoc与N-Bz保护的四氢-β-咔啉底物均能够良好的兼容,并以良好至优秀的收率与对映选择性获得相应目标产物。但当芳基中的取代基与四氢-β-咔啉底物中的N-H邻近时(2i),由于存在邻近的甲基取代基与N1位置氢键相互作用的干扰,只能够以中等程度的对映选择性获得相应产物。
(图片来源:Angew. Chem. Int. Ed.)
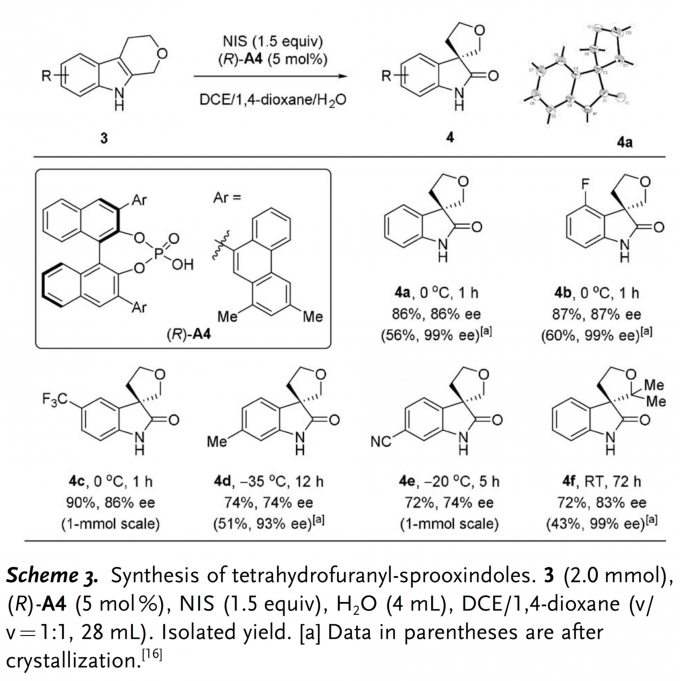
同时,作者对各种取代的四氢吡喃并吲哚化合物的应用范围进行考察(Scheme 3)。研究表明,通过调整反应条件,各种芳基取代的四氢吡喃并吲哚类化合物均能够较好的与上述反应条件兼容,并以良好的收率与优秀的对映选择性获得相应产物。
(图片来源:Angew. Chem. Int. Ed.)
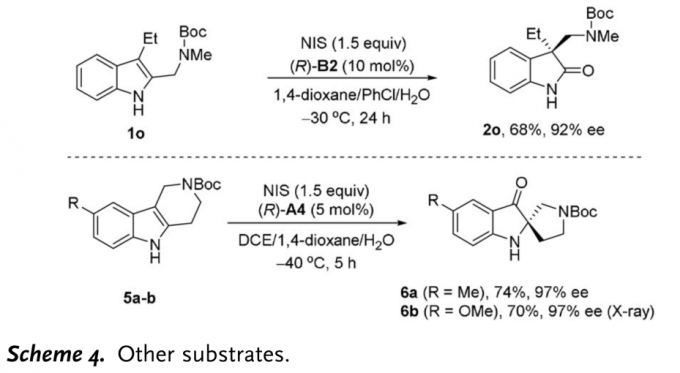
接下来,作者同样对其它类型底物的应用范围进行了考察(Scheme 4)。作者发现,在手性磷酸B2催化下,2,3-无环稠合的二取代吲哚1o同样能够有效地参与上述氧化重排过程,并以优秀的对映选择性获得相应手性3,3-二取代氧化吲哚2o。同时,研究发现,四氢-β-咔啉底物5a与5b却能够发生反向重排反应,获得高度对映体富集的的产物6a与6b。其中,6b的绝对构型通过X射线晶体学分析确定。此外,通过简单的衍生反应,(R)-2d可以转化为天然产物(-)-horsfiline(Figure 1)。
(图片来源:Angew. Chem. Int. Ed.)
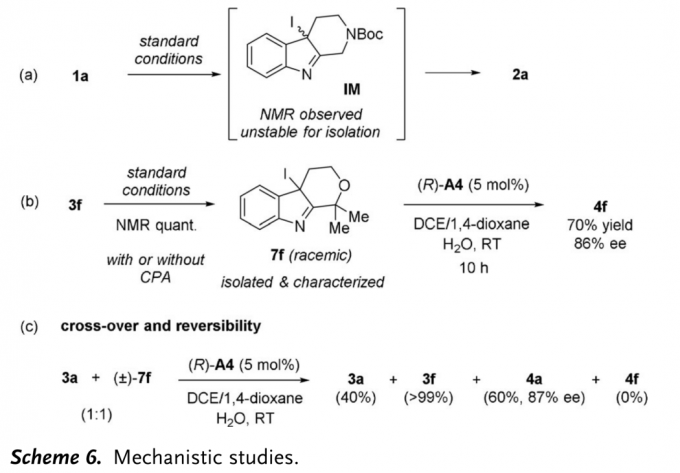
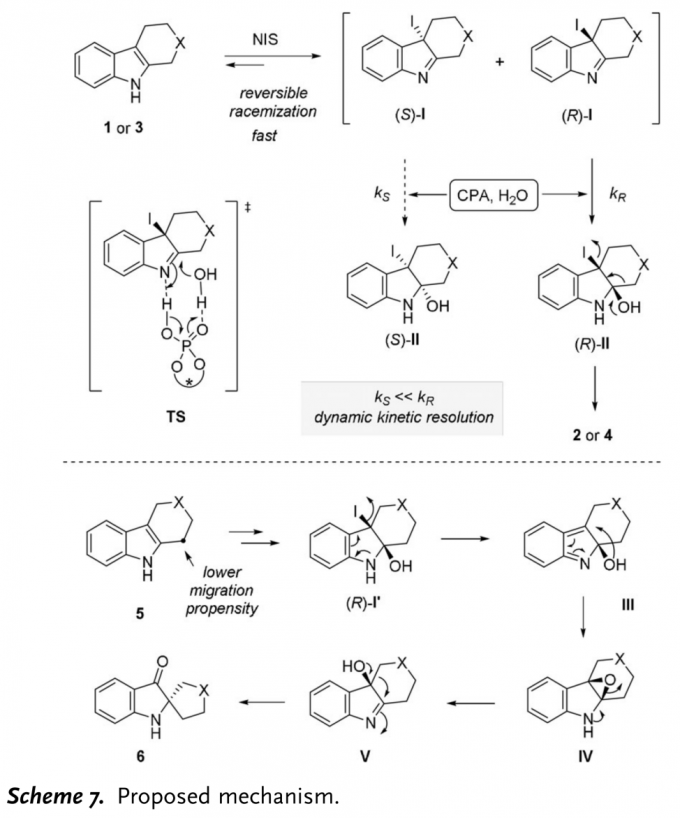
为提出合理的反应机理,作者进行一系列相关的控制实验(Scheme 6)。研究表明,在标准反应条件下,能够观察到1a的氧化重排反应中存在中间体IM。然而,由于该中间体不稳定,因此,未能进行相应的表征(Scheme 6a)。令人鼓舞的是,采用3f底物参与反应时,产生的中间体7f足够稳定,能够通过色谱分离并进行相应的表征。同时,作者发现,采用手性磷酸A4作为催化剂,中间体7f能够发生氧化重排反应,获得相应的手性产物(Scheme 6b)。这一实验观察能够排除不对称卤化过程作为对映选择性决定步骤的可能性。同时,作者进一步观察到,如果将外消旋7f的溶液进行搅拌,反应过程中能够检测到底物3f的生成,并观察到溶液逐渐变为紫色。这表明卤化步骤为可逆过程。
接下来,作者进行相关的交叉实验 (cross-over experiment)研究。首先,在不加入NIS的条件下,作者将外消旋的7f与3a 1:1的混合物与催化剂A4作用,最终观察到反应能以60%的收率与87%ee获得交叉产物4a,同时,可以观察到7f能够完全转化为3f(Scheme 6c)。而7f缓慢转化为3f的重排由于立体位阻原因无法参与竞争。这些结果进一步表明,卤化步骤为可逆过程,而随后的步骤决定反应过程的对映选择性。
(图片来源:Angew. Chem. Int. Ed.)
根据上述结论,作者提出一种可能的反应机理(Scheme 7)。首先,1a发生卤化反应,产生消旋中间体I。随后,H2O与I的亚胺部分发生亲核加成,产生中间体II。反应过渡态(TS)如下图所示,CPA作为双功能催化剂 (bifunctional catalyst),那个同时活化亚胺中间体I与H2O。因此,通过CPA的手性识别,(R)-I的反应速率明显快于(S)-I。其中,(S)-I能够通过可逆的卤化步骤发生外消旋化。因此,这一反应过程为动态动力学拆分 (dynamic kinetic resolution, DKR)过程。最终,(R)-II异构体通过发生1,2-迁移过程,转化为对映体富集的手性产物2或4。此外,作者认为底物5反向重排反应的机理为:首先,5转化为(R)-I´。同时,由于中间体(R)-I´2-取代基的低迁移能力,通过环化过程,形成环氧化物IV。IV在N原子孤对电子的协助下,通过开环过程,转化为中间体V。最终,V进一步通过semi-pinacol型重排反应获得产物6。
(图片来源:Angew. Chem. Int. Ed.)
小结:香港科技大学孙建伟教授团队成功发展出四氢-β-咔啉类化合物的不对称氧化重排反应。采用NIS作为氧化剂,手性磷酸作为催化剂,能够以良好至优秀的收率与对映选择性获得一系列对映体富集的螺氧化吲哚类化合物。
参考文献
- a) N. Finch, W. I. Taylor, Am. Chem. Soc.1962, 84, 1318. DOI: 10.1021/ja00866a062. b) J. Shavel, H. Zinnes, J. Am. Chem. Soc. 1962, 84, 1320. DOI: 10.1021/ja00866a063.
- F. Kolundzic, M. N. Noshi, M. Tjandra, Movassaghi, S. J. Miller, J. Am. Chem. Soc.2011, 133, 9104. DOI: 10.1021/ja202706g
















No comments yet.