本文作者:杉杉
导读
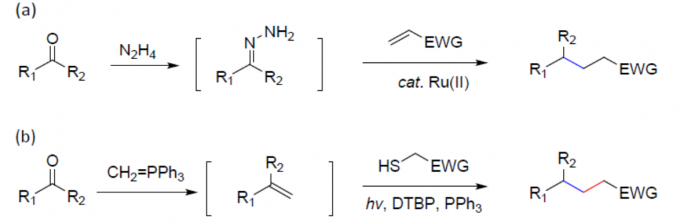
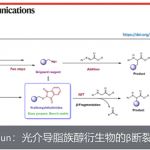
串联反应作为一种绿色且高效的策略,可通过一步反应快速构建多个碳-碳键。近日,上海交通大学药学院孙占奎课题组在Green Chemistry上发表论文,报道了一种可见光诱导的串联Wittig/加氢烷基化反应,涉及自由基加成的过程。同时,该反应具有反应条件温和、底物范围广和官能团耐受性好等特点。此外,通过对吲哚里西定类生物碱(indolizidine)209D的两步合成,进一步证明了反应的实用性。
Visible-light induced metal-free cascade Wittig/hydroalkylation reactions
Pannan Miao, Ruining Li, Xianfeng Lin, Liangming Rao, and Zhankui Sun
Green Chem. ASAP DOI: 10.1039/D1GC00091H
正文
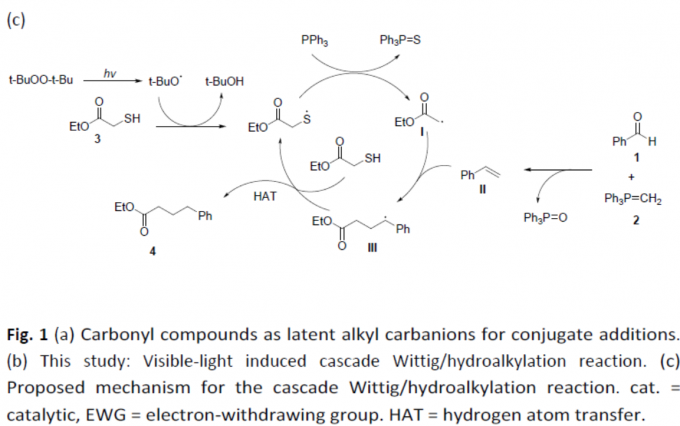
串联反应,作为快速构建复杂分子的有效策略,具有原子经济性、操作简单等特点。同时,串联反应常常涉及自由基参与的过程。通过醛或酮与磷叶立德(phosphonium ylide)的Wittig反应中,通常三苯氧膦作为副产物,若随后的反应可耐受三苯氧膦并以烯烃作为底物,串联反应则可实现。根据本课题组和其他课题组的研究[1],作者设计了一个可行的串联反应(Figure 1c)。首先,硫醇脱硫形成自由基中间体I,其中三苯膦硫化物为副产物。随后,自由基I与烯烃II(经Wittig反应形成)反应生成自由基中间体III。最终,通过氢原子转移形成目标产物4。此外,根据Li课题组所报道[2],只有一种特定方法可以实现一步转化,即以羰基化合物作为潜在的烷基碳负离子,使用Ru(II)催化缺电子烯烃的共轭加成。在此,上海交通大学药学院孙占奎课题组报道了一种可见光诱导的自由基串联的Wittig/加氢烷基化反应。
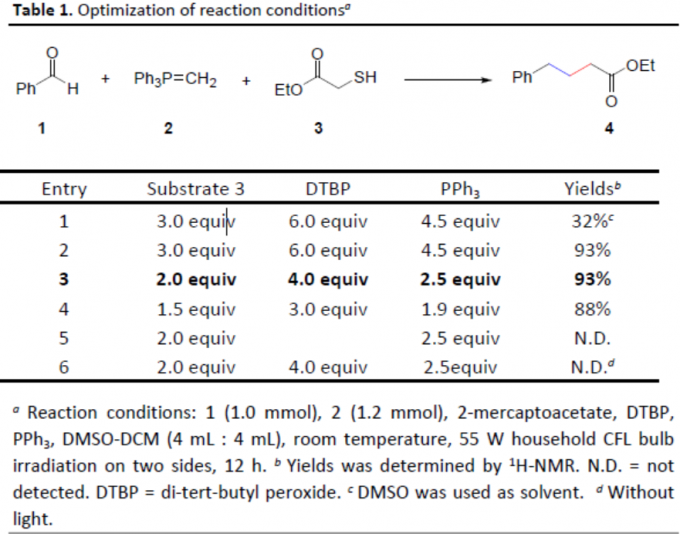
首先,作者以苯甲醛(1)、叶立德(2)和2-巯基乙酸乙酯(3)作为模型底物,进行了相关反应条件的筛选(Table 1)。反应结果表明,使用4当量的DTBP,2.5当量的PPh3,DMSO/DCM为混合溶剂,可在室温下于55W的光照条件下反应,获得93%收率的目标产物4。
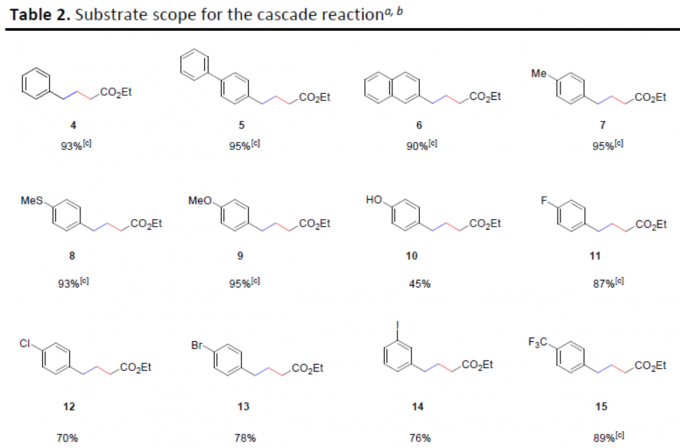
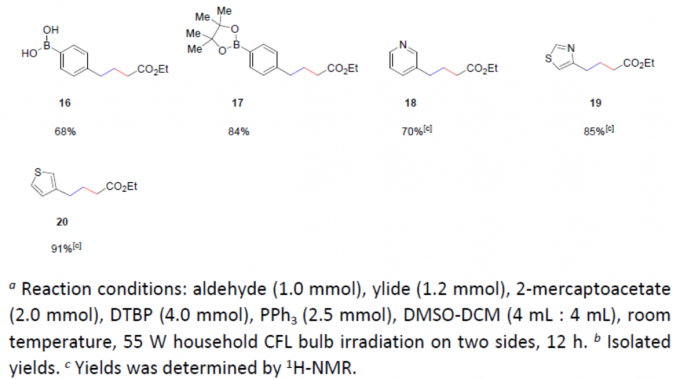
在获得上述最佳反应条件后,作者首先对芳醛的底物范围进行了扩展(Table 2)。具有多种供电子基团(Ph、OMe、SMe和Me)和吸电子基团(Cl、Br、I和CF3)的芳醛,均可顺利反应,以优异的收率获得相应的产物5–9和11–15。同时,含有游离羟基和硼酸基团,也可获得产物10和16,但收率偏低。此外,硼酸酯基团以及杂环芳醛(如吡啶甲醛、噻唑醛和噻吩醛)均可获得较高收率的目标产物17–20。
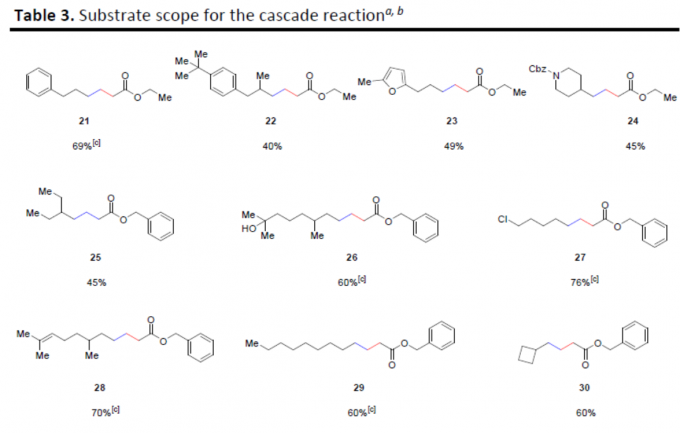
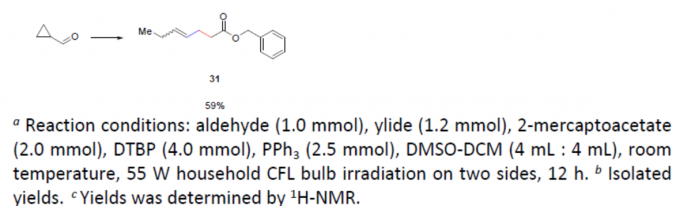
随后,作者对脂族醛的底物范围进行了扩展(Table 3)。当以3-苯基丙醛、3-(呋喃-2-基)丙醛、N-Cbz-哌啶醛为底物时,均可获得中等收率的产物21–24。同时,具有不同的线性脂族醛底物,也以中等至良好的收率获得产物25–30。其中,含有羟基(26)和氯原子(27)的底物均可耐受。此外,对于环丙基醛底物,由于发生开环反应,仅获得59%收率的开环产物31,这也进一步表明反应涉及自由基的过程。
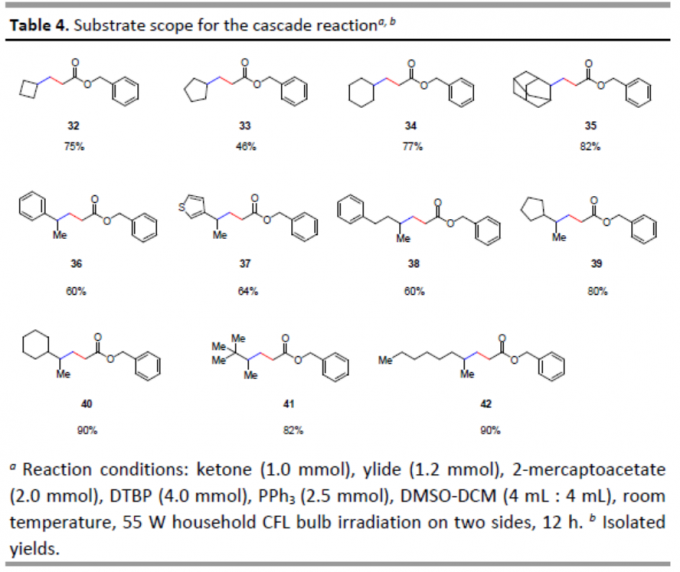
紧接着,作者对各种酮的底物范围进行了扩展(Table 4)。不同环系的酮类底物,均以中等至良好的收率获得产物32–35。同时,苯乙酮和3-乙酰基噻吩也与体系兼容,获得产物36–37。此外,其他线性酮也以良好的收率获得相应的产物38–42。
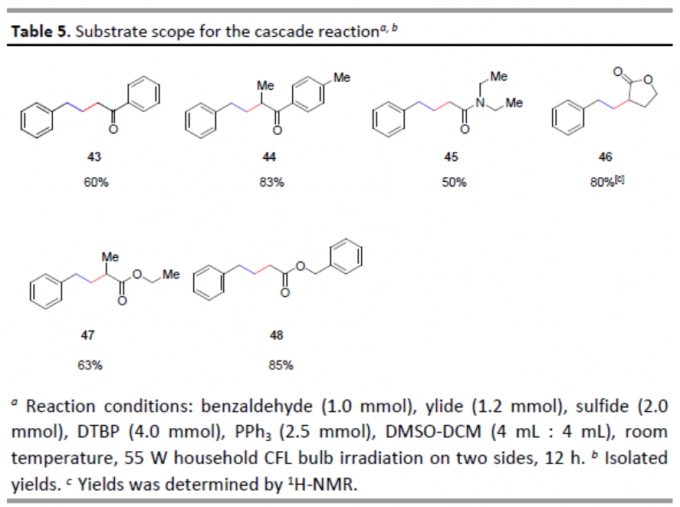
最后,作者还对硫醇的范围进行了扩展(Table 5)。具有乙酰基、酰胺基、内酯基和酯基的硫醇,均可顺利反应,获得中等至良好收率的相应目标产物43–48。
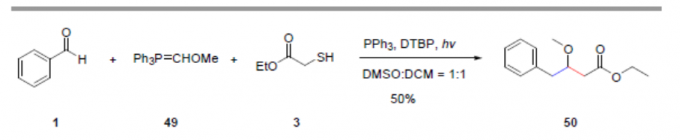
此外,作者还测试了其它的Wittig试剂,如化合物49。由于存在较低的空间位阻,仅能获得较低收率的目标产物50。
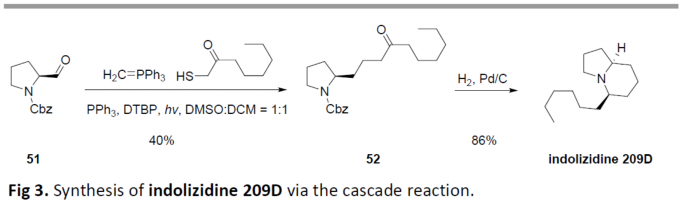
为了进一步证明反应的实用性,作者通过两步法成功合成了吲哚里西定类生物碱209D(Fig 3.)。首先,以市售的醛51为底物,通过一步反应合成化合物52,收率为40%。随后,经氢化反应,即可获得吲哚里西定类生物碱209D,收率为86%。因此,可通过两步法以34%的总收率获得目标产物。
总结
上海交通大学药学院孙占奎课题组报道了一种无金属催化可见光诱导的串联Wittig/加氢烷基化反应,涉及自由基反应的过程。同时,该反应具有温和的反应条件、广泛的底物范围和良好的官能团耐受性等特点。此外,通过对吲哚里西定类生物碱(indolizidine)209D的两步合成,进一步证明了反应的实用性。


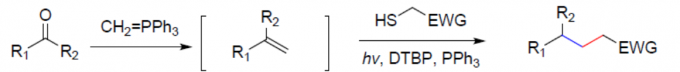













No comments yet.