本文作者:陈十五
导读
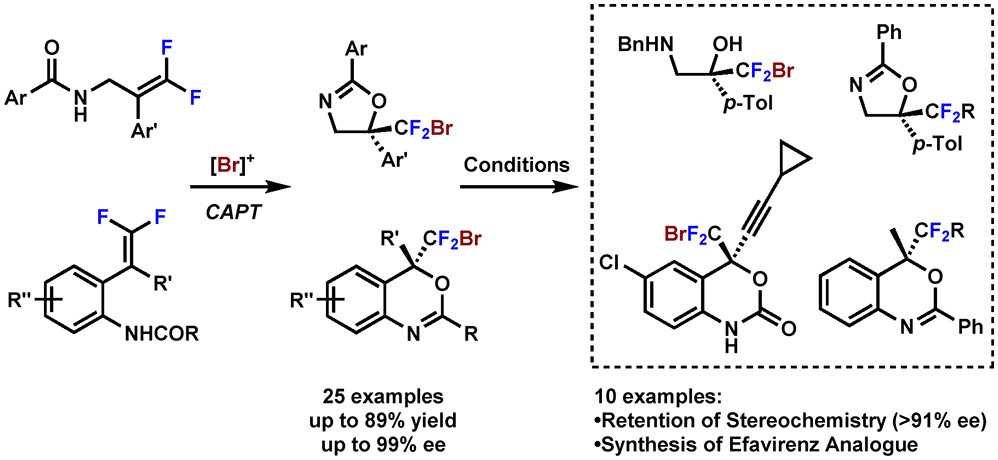
二氟亚甲基的化合物不仅能模仿传统官能团的生物学功能还能兼具多种因C-F键带来的药理优势,因此过去的几十年中该类化合物引起了化学家广泛的研究兴趣。作者报告了一种新颖的合成策略,能通过手性阴离子相转移剂实现二氟烯烃的溴环化催化,以高度区域选择性和对映选择性快速构筑含RCF2Br的杂环分子。 这种策略实用性很强,能用于合成治疗艾滋病毒的依非韦伦的类似物。 此外,对CF2Br中间体的进一步官能团化可以获得大量手性的含α,α-二氟亚甲基的产物,这也证明了该方法的实用性。
Regio- and Enantioselective Bromocyclization of Difluoroalkenes as a Strategy to Access Tetrasubstituted Difluoromethylene-Containing Stereocenters
Edward Miller, Suhong Kim, Katarina Gibson, Jeffrey S. Derrick, and F. Dean Toste* J. Am. Chem. Soc. ASAP DOI: 10.1021/jacs.0c02331
正文
性质到应用:二氟亚甲基化合物的重要性
含氟基团可以赋予药物分子多种独特的药理特性,例如亲脂性增加,抗氧化性和调节生物利用度可调,而二氟亚甲基单元(RCF2R’/RCF2H)性质更为特殊。在药物化学环境中,CF2基团与极性官能团类似,可作为亲脂性模拟物,并可以替代磷酸盐,硫酸盐,和芳基醚中的单个氧原子。由于C-H键的高度极化作用,二氟甲基(RCF2H)已证明是亲脂性氢键的供体,这使其可以作为醇和硫醇的生物等电子体,二氟亚甲基在分子识别模拟中也表现出具有巨大的潜力。
结构到合成:二氟亚甲基化合物合成局限性
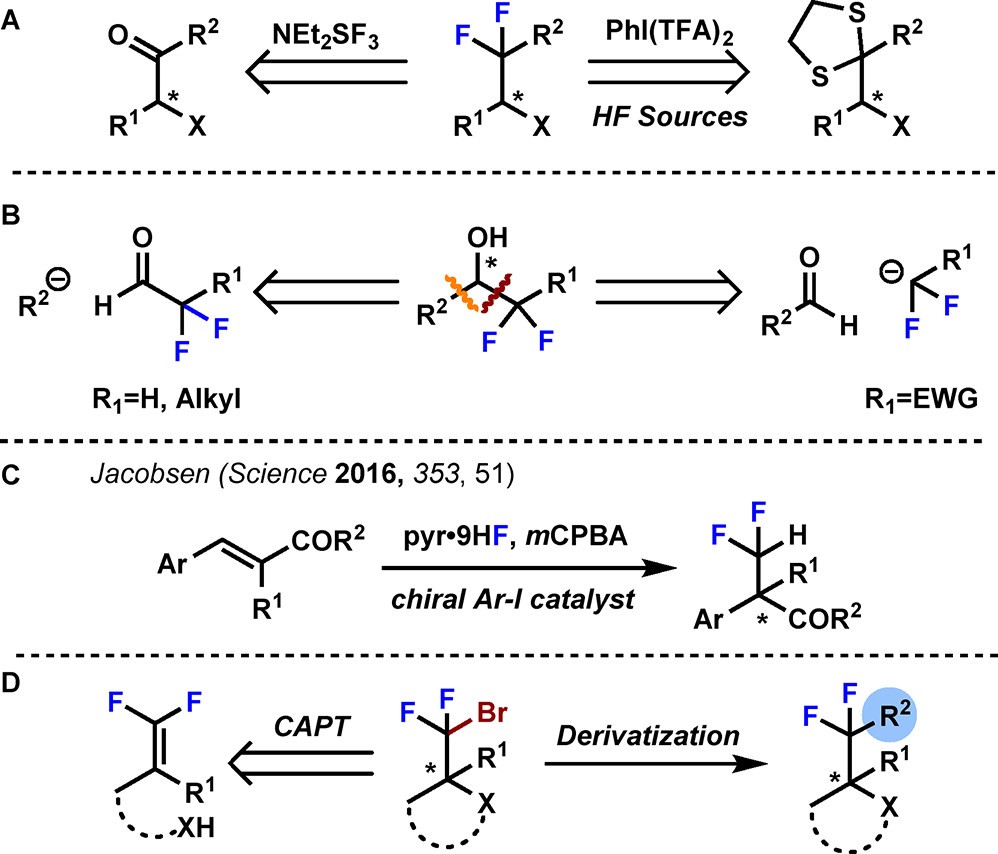
含氟药物的调查表明二氟亚甲基相关药物相对较少,这主要是因为传统合成方法,如羰基或羰基类似物的氟化(图1A)需要苛刻的酸性条件,杂环和对酸敏感的官能团无法耐受。α位置的取代基使反应经历碳正离子重排过程消旋,这大大降低了该策略在α-立体中心的化合物的适用性。目前比较有效的方法是将含氟亲核试剂对映选择性亲核加成到羰基上(图1B),但该方法的需要带有强吸电子基团(例如羰基和砜)的亲核试剂以增强其稳定性。尽管这些策略确实提供了二氟甲基手性中心的构筑途径,但它们通常仅限于醛的功能化。此前,Jacobsen研究小组在Science杂志上报告了通过手性芳基碘化物催化烯烃的二氟化直接构筑二氟甲基化立体中心(图1C)。基于以上工作,作者大胆假设了一种通过对二氟烯烃的溴环化可以快速获得四取代含有二氟亚甲基的手性化合物的策略(图1D)。
图1 构筑手性二氟亚甲基方法学综述(图片来源:J. Am. Chem. Soc.)
设计到筛选:手性相转移催化剂体系不负众望
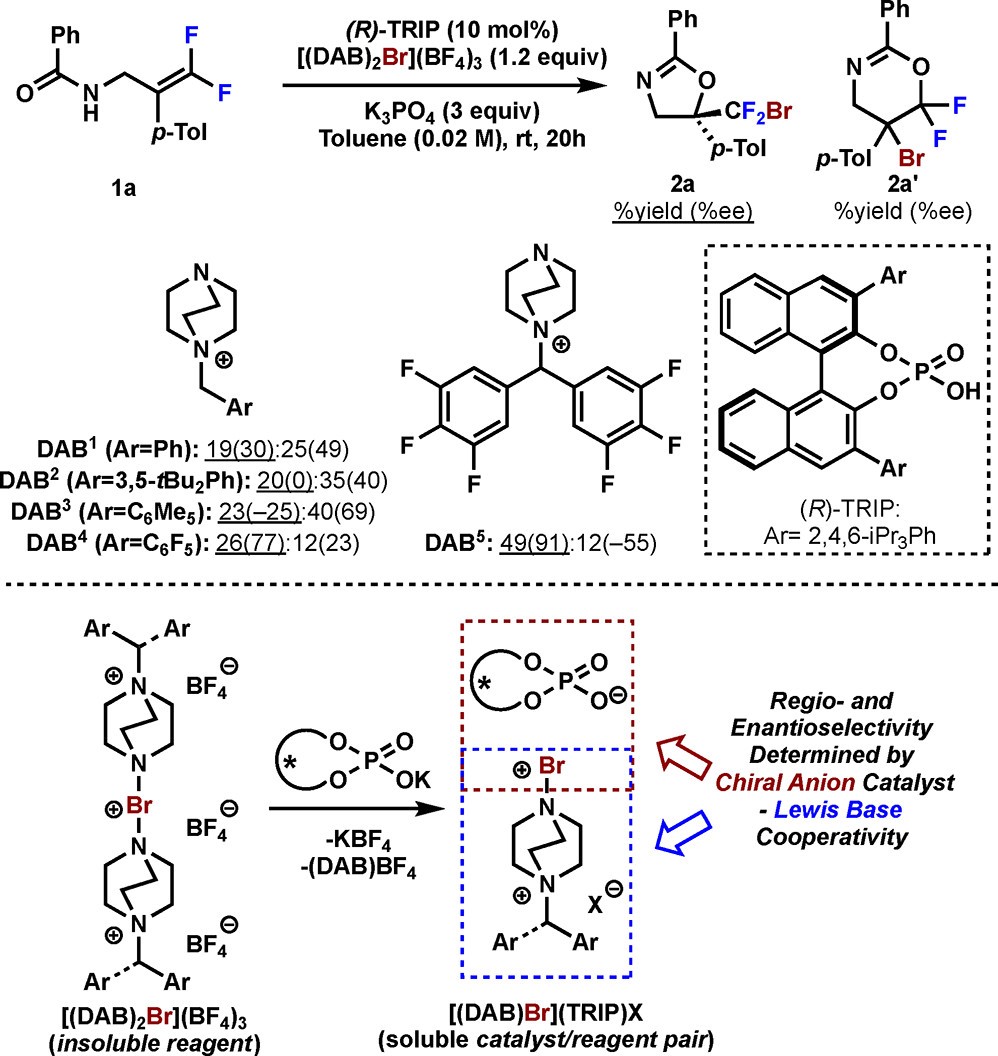
作者选择内酰胺作为亲核试剂(图2,1a)来合成含溴二氟甲基的噁唑啉2a,并且可以进一步还原为链状氨基醇。作者设计了阴离子相转移催化策略,采用[(DAB1)2Br](BF4)3作为亲电溴化试剂,10 mol%(R)-TRIP作为相转移催化剂,以19%收率,30%ee值得到目标产物(图2)。之前研究表明Lewis碱和阳离子的配对可以影响反应区域选择性2,因此作者假设该修饰过的1,4-二氮杂双环[2.2.2]辛烷(DABCO)能与相转移催化剂形成离子对提高区域选择性(图2)。通过条件筛选,作者发现大位阻的DABCO溴化试剂会抑制反应,而其中的吸电子芳环则会提高对映选择性。最终,[(DAB5)2Br](BF4)3可以给出75%的产率和90%的ee值。
图2 条件筛选和阴阳离子对模型(图片来源:J. Am. Chem. Soc.)
理论到实践:底物适用范围测试
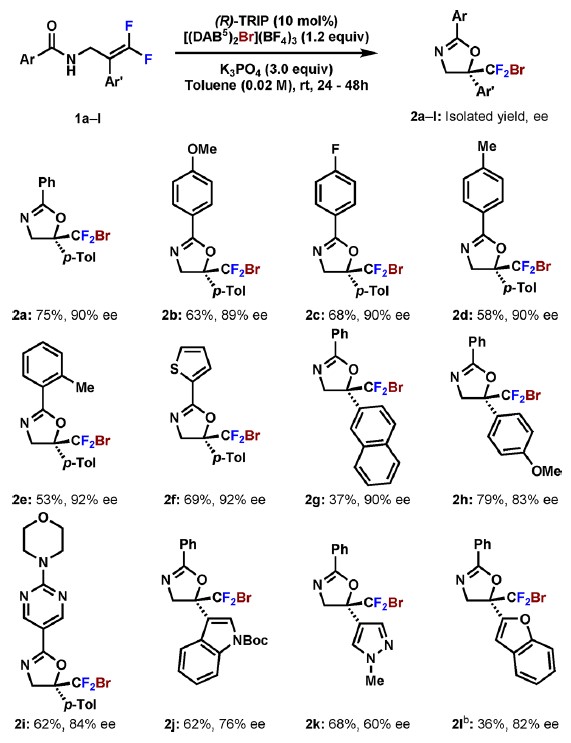
底物反应范围的研究表明产率和对映选择性不受亲核试剂自身的空间和电子效应以及二氟烯烃上的烷基成分(R’)的影响(图3),二氟苯乙烯的结构改变则会影响其产率和对映选择性。重要的是,杂环底物和类药骨架也能很好的在该体系下兼容。
图3 噁唑啉类转化底物使用性测试(图片来源:J. Am. Chem. Soc.)
在类似的条件下,底物3a被有效地环化为二氟溴甲基嗪类化合物4a。与噁唑啉类底物不同,芳族亲核试剂和二氟烯烃上的烷基成分(R’)改变对反应轻均没有太大影响(图4)。
图4 噁嗪类转化底物适用性测试(图片来源:J. Am. Chem. Soc.)
应用与拓展:自由基与离子型途径衍生化
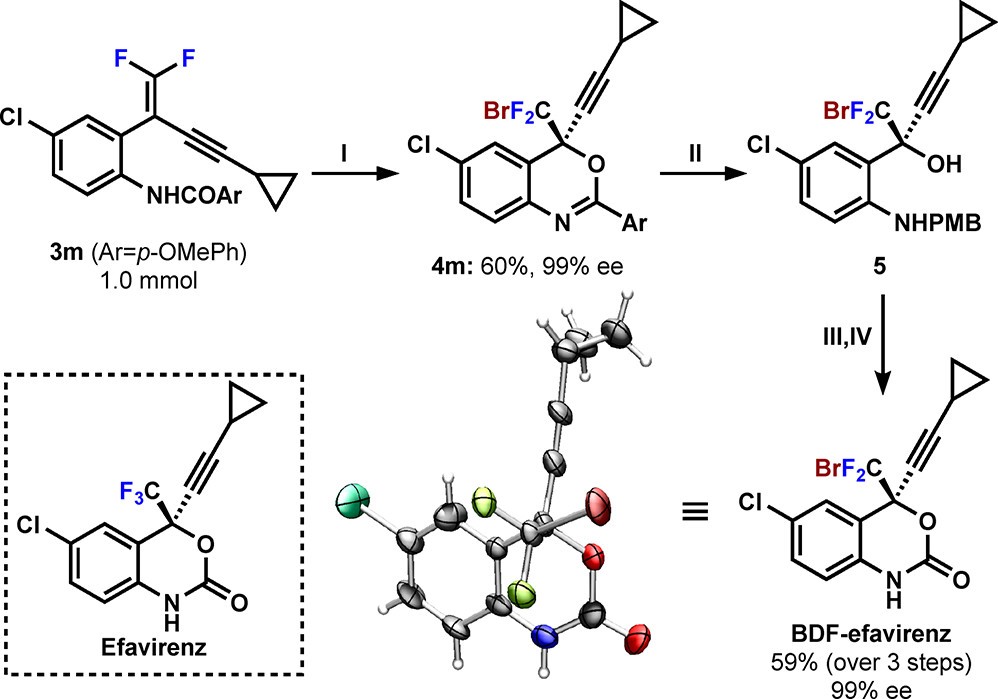
作者最后研究了该方法学的应用价值。他们不仅能实现较大规模(1.0 mmol)底物3m到产物4m的溴环化(图5),还能以4m为起始原料,以59%的总收益合成溴二氟依非韦伦类似物(BDFefavirenz)。该应用强有力地证明 该策略用于C(sp3)-CF2Br立体中心构筑的价值。
图5 依非韦伦类似物的合成应用(图片来源:J. Am. Chem. Soc.)
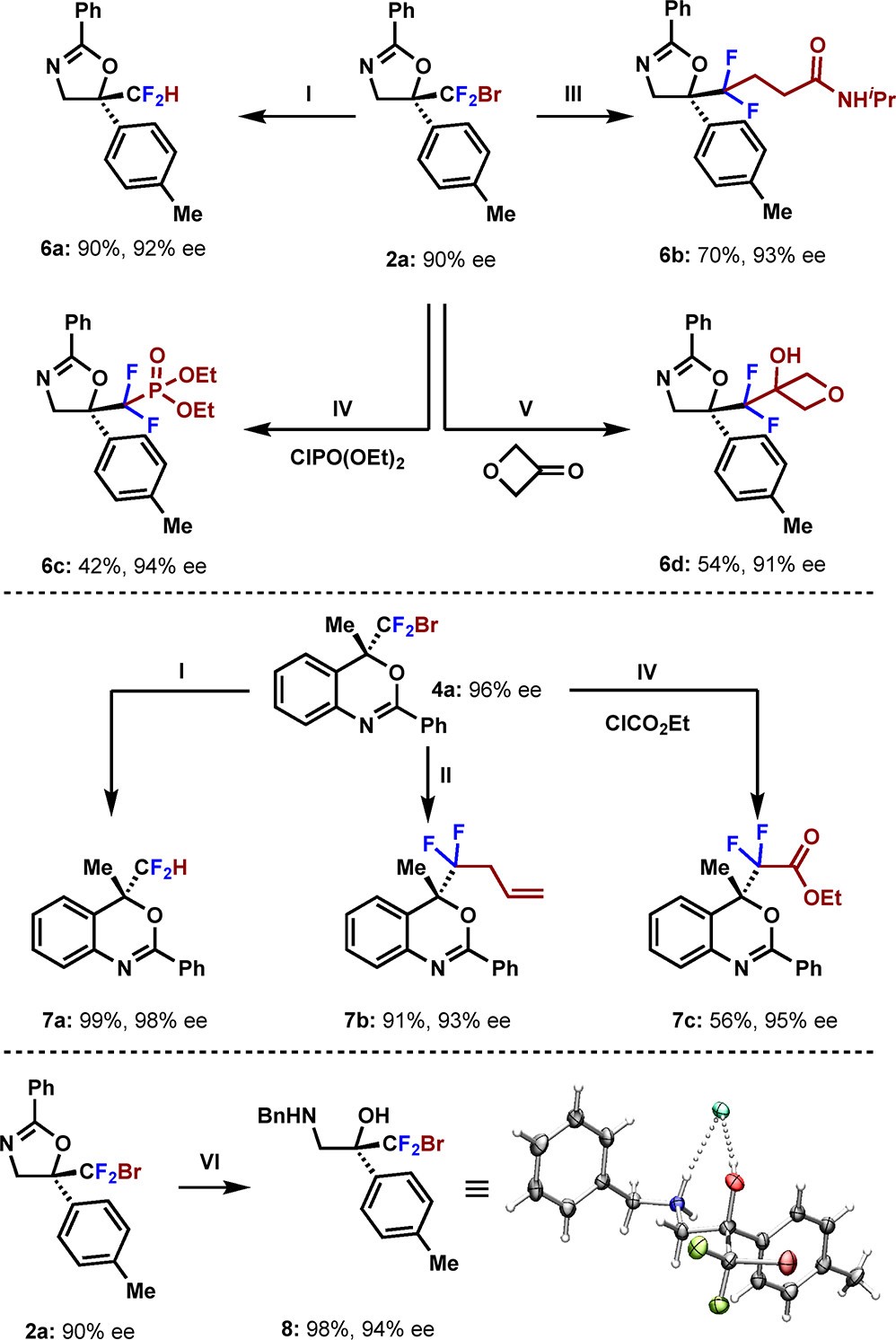
除此之外,作者利用Bu3SnH脱溴还原,Keck自由基烷基化,光催化等方法得到二氟亚甲基自由基轻松制备一系列产物,并保留了二氟亚甲基手性中心。化合物2a还能以离子型机理锂-卤素交换在-130oC下得到二氟酸酯7c,可以进一步通过脱羧氟化制备18F标记的三氟甲基衍生物。
图6 RCF2Br的衍生化反应(图片来源:J. Am. Chem. Soc.)
总结与展望:高效构筑二氟亚甲基手性中心
Toste团队在之前几年中用手性磷酸阴离子来做相转移催化剂,实现了烷基化反应、Michael 加成反应、Aldol 反应、Mannich反应等多种转化,如今又拓展这一体系,实现了二氟烯烃的溴环化以构筑二氟甲基手性中心。作者除了用广泛的底物种类证明了其强大的底物兼容性,更是巧妙的运用该策略简便快捷地合成了依非韦伦(efavirenz)类似物,这为进一步的工业应用提供理论基础。作者也希望该方法学在将来不仅可以被应用于更多的二氟亚甲基中心的手性构筑,别的研究团队也能由此启发,解决更多手性中心精准构筑的难题。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




















No comments yet.